
【题目】碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)汽车尾气中的处理NO的方法也可用H2将NO还原为N2。
已知: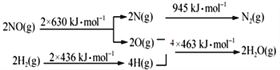
H2还原NO生成氮气和水蒸气的热化学方程是_______________________________。
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,利用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的一种新举措,反应原理为CO(g)+2H2(g)![]() CH3OH(g) ΔH。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH 的体积分数在不同压强下随温度的变化如图。
CH3OH(g) ΔH。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH 的体积分数在不同压强下随温度的变化如图。
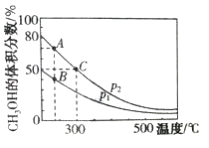
①上述合成甲醇的反应是__________________(填“吸热”或“放热”)反应,图像中的压强p1、p2的大小关系是_______________,判断的理由是________________________。
②从上图A、B、C三点中选填下表物理量对应最大的点(用“A”、“B”或“C”填写)。
反应速率V | 平衡常数K | 平衡转化率a |
____________ | _____________ | _____________ |
③在300℃时,向C点平衡体系中再充入0.25molCO、0.5molH2和0.25molCH3OH。该平衡_________(填“向正反应方向”、“向逆反应方向”或“不”)移动。
(3)有利于提高CO平衡转化率的措施有_________________。
A.使用催化剂 B.投料比不变,增加CO的浓度
C.降低反应温度 D.通入He气体使体系的压强增大
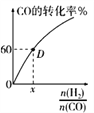
(4)一定温度下,CO的转化率与起始投料比![]() 的变化关系如图所示,测得D点氢气的转化率为40%,则x=__________________。
的变化关系如图所示,测得D点氢气的转化率为40%,则x=__________________。
【答案】 2NO(g)+2H2(g)=N2(g)+2H2O(g) △H1= -665 kJmol-1 放热 p1<p2 该正反应为气体分子数减小的反应,相同条件下增大压强甲醇的体积分数增大; C AB A 向正反应方向 C 3
【解析】(1)根据能量变化图,则反应断键共吸收2×630+2×436=2132kJ,形成共放出945+4×463=2797kJ,所以该反应共放出2797-2132=665kJ的热量,热化学方程式为2NO(g)+2H2(g)═N2(g)+2H2O(g)△H=-665 kJmol-1,故答案为:2NO(g)+2H2(g)═N2(g)+2H2O(g)△H=-665 kJmol-1;
(2)①根据图像,升高温度,CH3OH 的体积分数减少,平衡逆向移动,因此合成甲醇的反应放热反应;该反应后气体的物质的量减少,增大压强,平衡正向移动,CH3OH 的体积分数增大,因此图像中的压强p1<p2,故答案为:放热;p1<p2;该正反应为气体分子数减小的反应,相同条件下增大压强甲醇的体积分数增大;
②压强越大、温度越高,化学反应速率越快,压强P2>P1,温度C点最高,所以反应速率最快的是C点;化学平衡常数只与温度有关,根据图知,温度越高,甲醇含量越低,说明平衡逆向移动,则正反应是放热反应,温度越高,化学平衡常数越小,C点温度高于A和B点且AB点温度相同,所以化学平衡常数最大的是AB;甲醇的含量越大,则反应物转化率越大,所以甲醇转化率最大的是A点,故答案为:C;AB;A;
③C点甲醇的体积分数为50%,即甲醇的物质的量分数为50%,设反应掉的n(CO)=xmol,
CO(g)+2H2(g)CH3OH(g)
起始(mol) 1 2 0
反应(mol) x 2x x
平衡(mol) 1-x 2(1-x) x
![]() ×100%=50%,x=0.75,设容器体积为1L,则平衡时c(CH3OH)=0.75mol/L、c(CO)=0.25mol/L、c(H2)=0.50mol/L,化学平衡常数K=
×100%=50%,x=0.75,设容器体积为1L,则平衡时c(CH3OH)=0.75mol/L、c(CO)=0.25mol/L、c(H2)=0.50mol/L,化学平衡常数K=![]() =12,向C点平衡体系中再充入0.25molCO、0.5molH2和0.25mol的 CH3OH,此时c(CH3OH)=1mol/L、c(CO)=0.50mol/L、c(H2)=1mol/L,浓度商=
=12,向C点平衡体系中再充入0.25molCO、0.5molH2和0.25mol的 CH3OH,此时c(CH3OH)=1mol/L、c(CO)=0.50mol/L、c(H2)=1mol/L,浓度商=![]() =2<K,则平衡正向移动,故答案为:向正反应方向;
=2<K,则平衡正向移动,故答案为:向正反应方向;
(3)A.使用催化剂,平衡不移动,CO平衡转化率不变,错误;B.投料比不变,增加CO的浓度,CO的转化率降低,错误;C.降低反应温度,平衡正向移动,CO的转化率增大,正确;D.通入He气体使体系的压强增大,反应物和生成物的浓度不变,平衡不移动,CO的转化率不变,错误;故选C;
(4)设n(H2)=amol、n(CO)=bmol,氢气的转化率为40%、CO的转化率为60%,根据方程式CO(g)+2H2(g)CH3OH知,参加反应的n(CO)为参加反应的n(H2)的一半,所以40%×amol=2bmol×60%, ![]() =
=![]() =x=3,故答案为:3。
=x=3,故答案为:3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】世界水产养殖协会网介绍了一种利用电化学原理净化鱼池中水质的方法,其装置如图所示。
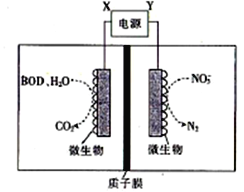
下列说法错误的是
A. X为电源正极
B. 若该装置在高温下进行,则净化效率将降低
C. 若BOD为葡萄糖(C6H12O6),则1mol葡萄糖被完全氧化时,理论上电极上流出24mole-
D. 若有1molNO3-被还原,则有6molH+通过质子膜迁移至阴极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 molL-1的NaOH溶液240 mL,根据溶液的配制情况回答下列问题:
(1)实验中除了用到托盘天平、药匙、量筒、烧杯外,还需用到的仪器有________。
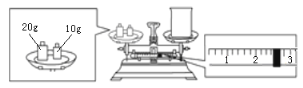
(2)通过计算可知,该实验需要称量NaOH_____g;某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如下图所示,则烧杯的实际质量为___g。
(3)使用容量瓶前必须进行的一步操作是________。
(4)在配制过程中,下列操作会使溶液浓度偏大的是_____(填序号)。
A.转移溶液时不慎有少量洒到容量瓶外面
B.定容时俯视刻度线
C.未冷却到室温就将溶液转移到容量瓶并定容
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,海水中氯化物的含量相当高,主要是氯化钠,其次是氯化镁、氯化钙和氯化钾等。从海水中提取食盐和溴的过程如下:
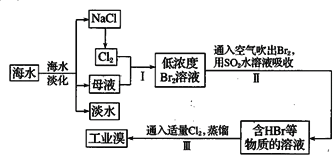
(1)氯原子的结构示意图为____________________。
(2)用NaCl为原料生产氯气的化学方程式为___________________________________。
(3)步骤Ⅱ中用热空气就可以把Br2吹出来的原因是_____________________________。
(4)步骤Ⅱ中用SO2水溶液吸收Br2,可制得HBr和硫酸,试写出该反应的化学方程式_________________________________________________。
(5)步骤Ⅲ用氯气提取溴,这是利用了氯气的__________性。(填“氧化”或“还原”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异成二烯和萜等众多“分子共和国”中的明星。
(1)写出Fe2+的核外电子排布式__________。
(2)下列说法正确的是_______。
a.H2S和O3分子的构型相同
b.BF3和NH3分子的极性相同
c.CO2、HCN分子中C原子的杂化方式相同
d.CH3COOH分子中C原子的杂化方式相同
(3)N3-与CO2分子互为等电子体,则N3-的空间构型为_______。含Co3+的配合物Co[(N3)(NH3)5]SO4中的配体是_________。
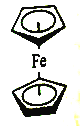
(4)二茂铁是由C5H5-和Fe2+形成的配合物,其结构如图所示。该配合物中共含有____种化学环境不同的氢。
(5)砷和氮位于同一主族,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,它们有着广泛的用途。同答下列问题:
①写出砷的价电子排布式___________。
②工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出该反应的化学方程式: ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述中,正确的是( )
A.离子化合物中可能含有共价键B.氢键是一种特殊的共价键
C.I2的升华破坏了共价键D.非金属元素间不可能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】山萘酚(Kaempf erol)结构如下图所示,且大量存在于水果、蔬菜、豆类、茶叶中,具有多种生物学作用,如抗氧化、抑制肿瘤生长及保护肝细胞等作用。下列有关山萘酚的叙述正确的是 ( )
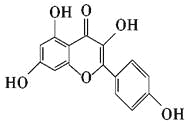
A. 结构式中含有羟基、醚键、酯基、碳碳双键
B. 可发生取代反应、水解反应、加成反应
C. 可与NaOH反应,不能与NaHCO3反应
D. 1 mol山萘酚与溴水反应最多可消耗4 mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3·H2O) =1.76×10-5,下列说法正确的是( )
A. 将CH3COONa溶液从20℃升温至30℃,溶液中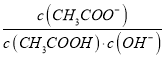 增大
增大
B. 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C. 0.2 mol/L HCOOH 与 0.1 mol/L NaOH 等体积混合后:c(HCOO-) + c(OH-) = c(HCOOH) + c(H+)
D. 0.2 mol/L CH3COONa 与 0.1 mol/L盐酸等体积混合后 (pH<7):c(CH3COO-) > c(Cl- ) >c(CH3COOH) >c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com