
 计算溶液的质量分数,根据溶液稀释前后溶质的物质的量不变计算稀释后的浓度;
计算溶液的质量分数,根据溶液稀释前后溶质的物质的量不变计算稀释后的浓度;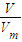 计算气体的物质的量,根据N=n×NA计算分子数,然后计算溶液的质量和溶质的质量,进而计算溶液的质量分数,根据c=
计算气体的物质的量,根据N=n×NA计算分子数,然后计算溶液的质量和溶质的质量,进而计算溶液的质量分数,根据c=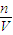 计算溶液的物质的量浓度.
计算溶液的物质的量浓度.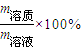 =
=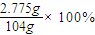 =2.67%;
=2.67%;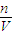 =
=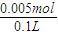 =0.05mol/L.
=0.05mol/L.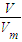 =
=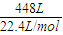 =20mol;
=20mol;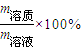 =
=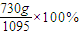 =66.7%;
=66.7%;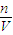 =
=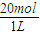 =20mol/L,
=20mol/L,

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH均为12的烧碱与Ba(OH)2溶液的物质的量浓度之比 | B、(NH4)2SO4溶液中c(NH4+)与c(SO42-)之比 | C、100mL0.2mol/L的HCl与100mL0.1mol/L的H2SO4溶液中c(H+)之比 | D、相同温度下,0.2mol/L的醋酸溶液与0.1mol/L的醋酸溶液中c(H+)之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com