
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。
(1)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图所示。
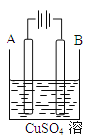
请回答:
①A电极对应的金属是 (写元素名称),B电极的电极反应式是 。
②镀层破损后,镀铜铁和镀锌铁更容易被腐蚀的是 。
(2)下列哪个装置可防止铁棒被腐蚀
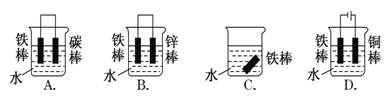
(3)利用右图装置可以模拟铁的电化学防护。
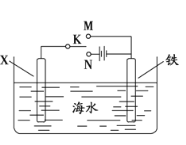
①若X为碳棒,为减缓铁的腐蚀,开关K应置于 处。假设海水中只有NaCl溶质,写出此时总离子反应方程式:
②若X为锌,开关K置于M处,该电化学防护法称为 ,写出铁电极处的电极反应式:
【答案】(1)①铜(1分)Cu2++2e-=Cu(2分)②镀铜铁(1分)(2)BD(2分)
(3)①N(1分)2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑(2分)
2OH-+H2↑+Cl2↑(2分)
②牺牲阳极的阴极保护法(1分)O2+2H2O+4e—=4OH—(2分)
【解析】
试题分析:(1)①电镀时待镀金属作阴极,镀层金属作阳极。A电极与电源的正极相连,作阳极,对应的金属是铜,B电极是铁,溶液中的铜离子放电,电极反应式是Cu2++2e-=Cu。
②金属性是Zn>Fe>Cu,所以镀层破损后,镀铜铁和镀锌铁更容易被腐蚀的是镀铜铁。
(2)A、铁、石墨和水构成原电池,铁是负极,被腐蚀,A错误;B、锌的金属性强于铁,铁是正极,被保护,B正确;C、铁棒放在水中容易发生电化学腐蚀,C错误;D、铁和电源的负极相连,作阴极被保护,D正确,答案选BD。
(3)①若X为碳棒,为减缓铁的腐蚀,开关K应置于N处构成电解池,铁是阴极,被保护;假设海水中只有NaCl溶质,此时总离子反应方程式为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
②若X为锌,开关K置于M处构成原电池,铁是正极,被保护,该电化学防护法称为牺牲阳极的阴极保护法,铁电极处氧气得到电子,电极反应式为O2+2H2O+4e—=4OH—。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用0.1 molL-1的NaOH溶液分别滴定体积均为20mL、浓度均为0.1 molL-1的HC1溶液和HX溶液,溶液的pH随加入NaOH溶液体积的变化如图所示。下列说法正确的是
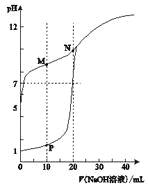
A. M点对应溶液中:c(HX)<c(X-)
B. HX的电离平衡常数Ka约为1×10-5
C. P点对应溶液中 c(Cl-) ="0.05" mol L-1
D. N点对应溶液pH>7的原因是X-+ H2O![]() HX+OH-
HX+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.含有离子键的化合物一定是离子化合物
B.非金属之间形成的化学键不一定是共价键
C.含有共价键的化合物不一定是共价化合物
D.在共价化合物中也可能含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质、制取或应用等的说法中正确的是
A. 二氧化锰具有强氧化性,可用作H2O2分解的氧化剂
B. Al2O3的熔点很高,可制作耐高温材料,工业上也电解Al2O3来冶炼Al
C. K2FeO4具有还原性,可用于自来水的杀菌消毒
D. 水晶项链和餐桌上的瓷盘都是硅酸盐制品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中存在大量的OH-、SO42-、Na+,该溶液中还可能大量存在的离子是
A. NH4+ B. A1O2- C. Cu2+ D. Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用如图所示装置进行实验。
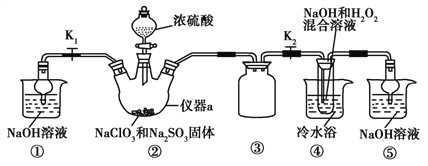
(1)仪器a的名称为____,装置①的作用是____,装置③的作用是______。
(2)装置②中产生ClO2,涉及反应的化学方程式为________________;装置④中反应生成NaClO2的化学方程式为_______________。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:①减压,55 ℃蒸发结晶;②趁热过滤;③______;④低于60 ℃干燥,得到成品。如果撤去④中的冷水浴,可能导致产品中混有的杂质是________。
(4)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是:取少量晶体溶于蒸馏水,_____________________。
(5)为了测定NaClO2粗品的纯度,取上述粗产品10.0 g溶于水配成1 L溶液,取出10 mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(NaClO2被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.20 mol·L-1Na2S2O3标准液滴定,达到滴定终点时用去标准液20.00 mL,试计算NaClO2粗品的纯度_____。(提示:2Na2S2O3+I2![]() Na2S4O6+2NaI)
Na2S4O6+2NaI)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,反应A2(g)+B2(g)![]() xC(g),符合图Ⅰ所示关系。对图Ⅱ的说法正确的是(T为温度、P为压强、t为时间) ( )
xC(g),符合图Ⅰ所示关系。对图Ⅱ的说法正确的是(T为温度、P为压强、t为时间) ( )
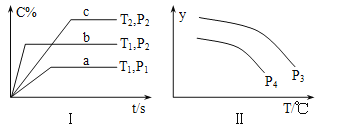
A. P3<P4,y为A2转化率
B. P3<P4,y为A2浓度
C. P3>P4,y为混合气密度
D. P3>P4,y为C的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题。
(1)乙烯的电子式为______________;
(2)当0.2mol烃A在足量氧气中完全燃烧时生成CO2和H2O各1.2mol,催化加氢后生成
2,2-二甲基丁烷,则A的结构简式为______________________________。
(3)某烃1mol与2molHCl完全加成,生成的氯代烷最多还可以与4molCl2反应,则该烃的结构简式为______________________。
(4)相对分子质量为72且沸点最低的烷烃的结构简式_______________________;
(5)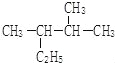 的名称(系统命名法)_______________________。
的名称(系统命名法)_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com