
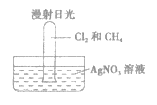
【题目】CH4和Cl2按照一定比例充入大试管中。将此试管倒立在盛有AgNO3溶液的水槽中,放在光亮处,片刻后发现试管内液面上升且壁上有油状液滴出现。
(1)CH4的电子式为__。
(2)CH4和Cl2反应生成一氯甲烷的化学方程式___。反应类型是___。
(3)此反应生成___种产物,产物中物质的量最多的是___。
(4)说明水槽中溶液的变化现象及原因___。
【答案】![]() CH4+Cl2
CH4+Cl2![]() CH3Cl+HCl 取代反应 5 HCl CH4和Cl2在光照条件下一开始生成CH3Cl(气体),随着Cl2的不断消耗,生成难溶于水的CH2Cl2、CHCl3、CCl4(均为油状液体)附着在试管壁上,试管内压强减小,水位在试管内上升,但不完全充满试管,同时生成的HCl溶于水后与AgNO3溶液反应,HCl+AgNO3===AgCl↓+HNO3,溶液中产生白色沉淀
CH3Cl+HCl 取代反应 5 HCl CH4和Cl2在光照条件下一开始生成CH3Cl(气体),随着Cl2的不断消耗,生成难溶于水的CH2Cl2、CHCl3、CCl4(均为油状液体)附着在试管壁上,试管内压强减小,水位在试管内上升,但不完全充满试管,同时生成的HCl溶于水后与AgNO3溶液反应,HCl+AgNO3===AgCl↓+HNO3,溶液中产生白色沉淀
【解析】
(1)甲烷为共价化合物,C原子与氢原子形成共用电子对,电子式为![]() ,故答案为
,故答案为![]() ;
;
(2)CH4和Cl2在光照条件下发生取代反应生成一氯甲烷,化学方程式为CH4+Cl2![]() CH3Cl+HCl,故答案为:CH4+Cl2
CH3Cl+HCl,故答案为:CH4+Cl2![]() CH3Cl+HCl;取代反应;
CH3Cl+HCl;取代反应;
(3)CH4和Cl2在光照条件下生成CH3Cl、CH2Cl2、CHCl3、CCl4、HCl共5中产物,其中HCl含量最高,故答案为:5;HCl;
(4)根据实验现象分析可知,CH4和Cl2在光照条件下一开始生成CH3Cl(气体),随着Cl2的不断消耗,生成难溶于水的CH2Cl2、CHCl3、CCl4(均为油状液体)附着在试管壁上,试管内压强减小,水位在试管内上升,但不完全充满试管,同时生成的HCl溶于水后与AgNO3溶液反应,HCl+AgNO3===AgCl↓+HNO3,溶液中产生白色沉淀,故答案为:CH4和Cl2在光照条件下一开始生成CH3Cl(气体),随着Cl2的不断消耗,生成难溶于水的CH2Cl2、CHCl3、CCl4(均为油状液体)附着在试管壁上,试管内压强减小,水位在试管内上升,但不完全充满试管,同时生成的HCl溶于水后与AgNO3溶液反应,HCl+AgNO3===AgCl↓+HNO3,溶液中产生白色沉淀。


科目:高中化学 来源: 题型:
【题目】将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示。则下列有关说法不正确的是
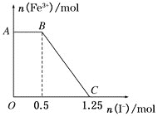
A.图中AB段主要是高锰酸钾和碘化钾溶液反应
B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol
D.根据OC段的数据可知开始加入的硫酸亚铁的物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
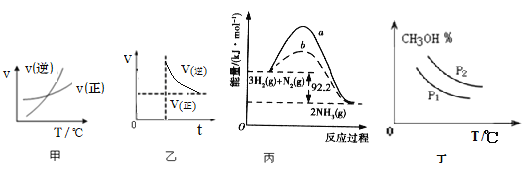
A.由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0
B.图乙表示反应NH2COONH4(s) ![]() 2NH3(g)+CO2(g)达到平衡后,增大压强,反应速率和时间的关系,达到新平衡后,氨气浓度不变,压强也不变
2NH3(g)+CO2(g)达到平衡后,增大压强,反应速率和时间的关系,达到新平衡后,氨气浓度不变,压强也不变
C.图丙向容器中充入 1 mol N2、3 mol H2,充分反应后放出热量 92.2 kJ
D.图丁可表示在不同压强P1、P2(P1>P2)条件下CO(g)+2H2(g) ![]() CH3OH(g) △H<0,甲醇百分含量随温度变化的情况
CH3OH(g) △H<0,甲醇百分含量随温度变化的情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子电池具有资源广泛、价格低廉、环境友好、安全可靠的特点,特别适合于固定式大规模储能应用的需求。一种以Na2SO4水溶液为电解液的钠离子电池总反应为:NaTi2(PO4)3 +2Na2NiFeII (CN)6 ![]() Na3Ti2(PO4)3 +2NaNiFeIII(CN)6(注:其中P的化合价为+5,Fe的上标II、III代表其价态)。下列说法不正确的是( )
Na3Ti2(PO4)3 +2NaNiFeIII(CN)6(注:其中P的化合价为+5,Fe的上标II、III代表其价态)。下列说法不正确的是( )
A.放电时NaTi2(PO4)3在正极发生还原反应
B.放电时负极材料中的Na+脱离电极进入溶液,同时溶液中的Na+嵌入到正极材料中
C.充电过程中阳极反应式为:2NaNiFeIII(CN)6+2Na++2e-=2Na2NiFeII (CN)6
D.该电池在较长时间的使用过程中电解质溶液中Na+的浓度基本保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨,s)=C(金刚石,s) △H=+1.9kJ/mol可知,金刚石比石墨稳定
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) △H=﹣285.8kJ/mol
D.在稀溶液中,H+(aq)+OH﹣(aq)=H2O(l) △H=﹣57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molKOH的溶液混合,放出的热量大于57.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
②为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
③相同温度下,将足量氯化银固体分别放入相同体积的a.蒸馏水b.0.1mol·L-1盐酸、c.0.1mol·L-1氯化镁溶液d.0.1mol·L-1硝酸银溶液中,Ag+浓度:a>d=b>c
④用0.2000mol·L-1NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol·L-1),至中性时,溶液中的酸未被完全中和
⑤将水加热到100℃,pH=6:c(OH)< c(H+)
⑥醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO-)> c(Na+)
⑦0.lmoI·L-1的硫酸铵溶液中:c(![]() )> c(
)> c(![]() )> c(H+)
)> c(H+)
⑧pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)= c(H+)
A.③⑤B.①⑧C.④⑦D.②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2C+O2=2CO的能量变化如图所示。下列说法正确的是( )
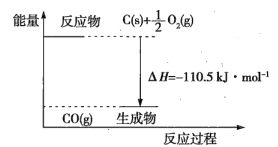
A.12gC(s)与一定量O2(g)反应生成14gCO(g)放出的热量为110.5kJ
B.2molC(s)与足量O2(g)反应生成CO2(g)放出的热量大于221kJ
C.该反应的热化学方程式是2C(s)+O2(g)=2CO(g) ΔH=-221kJ
D.该反应的反应热等于生成的CO(g)中所具有的能量与参加反应的O2(g)中所具有的能量的差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PETG是一种新型材料,可回收利用,对环境不构成任何威胁,其结构简式如下: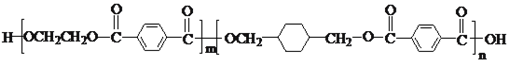 ,已知:RCOOR1+R2OH―→RCOOR2+R1OH(R、R1、R2表示烃基)。采用如下图所示的合成路线可合成PETG:
,已知:RCOOR1+R2OH―→RCOOR2+R1OH(R、R1、R2表示烃基)。采用如下图所示的合成路线可合成PETG:

试回答下列问题:
(1)试剂X为______________;反应⑦的反应类型为_______________。
(2)写出物质H的名称________________________。
(3)写出结构简式: I_____________________________。
(4)写出反应⑤的化学方程式:_________________________________________。
(5)合成时应控制的单体的物质的量n (D)∶n (F)∶n (H)=__________(用m、n表示)。
(6)同时符合下列要求的物质H的同分异构体共有__________种。
①遇FeCl3溶液显紫色;②能与NaHCO3溶液反应,并有气体放出;③能发生银镜反应。
(7)已知:![]() 请写出由D及其它必要物质可合成
请写出由D及其它必要物质可合成![]() 的反应历程。________________
的反应历程。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两池中的电极材料都是铁棒与碳棒,请回答下列问题。
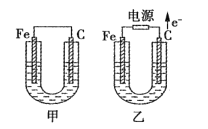
(1)若两池中的电解质溶液均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的__棒,乙池中的__棒。
②乙池中阳极的电极反应式是__。
(2)若两池中的电解质溶液均为饱和NaCl溶液:
①乙池中总反应的离子方程式为__。
②乙池中碳棒上的电极反应属于__(填“氧化反应”或“还原反应”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com