
| A、稀硝酸具有强酸性,实验室可用其制取少量氢气 |
| B、铝具有强氧化性,生产上可用铝热反应制取一些金属 |
| C、氢氧化铝具有两性,医疗上可用其治疗胃酸过多 |
| D、钠具有强还原性,可用其与硫酸铜溶液反应来制取铜 |


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
| A、卤化氢中,HF沸点较高,是由于HF分子间存在氢键 |
| B、邻羟基苯甲醛的熔沸点比对羟基苯甲醛的熔沸点低 |
| C、氨水中有分子间氢键 |
| D、氢键X-H…Y的三个原子总在一条直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤是工业上获得苯、甲苯、二甲苯等芳香烃的重要来源物质 |
| B、煤是多种有机物组成的混合物,内含煤焦油等成份 |
| C、煤除了含有碳元素外,还含有少量的N、H、O、S |
| D、工业上,煤的焦化可以获得洁净的燃料和多种化工原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH3CH2OH
| |||
B、CH3CHBrCH3+NaOH
| |||
C、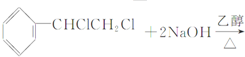  | |||
D、2CH3OH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使苯酚显紫色的溶液:NH4+、K+、SCN-、SO42- |
| B、使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- |
| C、由水电离的c(OH-)=10-13mol?L-1的溶液中:Na+、Cl-、CO32-、NO3- |
| D、c(Fe2+)=1.0 mol?L-1溶液:H+、K+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com