
����Ŀ��25��ʱ��������ĵ���ƽ�ⳣ�����±���ʾ��
��ѧʽ | CH3COOH | HClO | H3PO3 |
���� | ���� | ������ | ������ |
����ƽ�ⳣ�� | 1.8��10-5 | 3.0��10-8 | K1=8.3��10-3 K2=5.6��10-6 |
�ش��������⣺
��1��Ũ�Ⱦ�Ϊ0.1mol/L��CH3COOH��HClO�� H3PO3��Һ�У�c��H+����С����__________��
��2����������H3PO3��Ϊ��Ԫ�ᣬ���н�ǿ�Ļ�ԭ�ԡ�H3PO3�ĵ��뷽��ʽΪ___________��Na2HPO3��________��������ʽ��������ʽ������������������
��3�������£�0.1mol/L��CH3COOH��Һ��ˮϡ�͵Ĺ����У����б���ʽ����ֵһ��������_______������ĸ����
A��c��H+�� B��![]() C��c��CH3COO- �� D��c��CH3COOH��
C��c��CH3COO- �� D��c��CH3COOH��
��4�������Ϊ10mL��c��H+����Ϊ10-2mol/L�Ĵ�����Һ��һԪ��HX�ֱ��ˮϡ����1000mL��ϡ������c��H+���ı仯��ͼ��ʾ����HX�ĵ���ƽ�ⳣ��_________��������������С��������������������ĵ���ƽ�ⳣ����

���𰸡�
��1��HC1O ��Һ��
��2��H3PO3 ![]() H2PO3-+H+��H2PO3-
H2PO3-+H+��H2PO3-![]() HPO32-+H+;����
HPO32-+H+;����
��3��B��4������
��������
�����������1������������ĵ���ƽ�ⳣ����֪������H3PO3��CH3COOH��H2PO3-��HClO��Ũ�Ⱦ�Ϊ0.1mol/L��CH3COOH��HClO��H3PO3��Һ�У�������������HClO ����HClO��c��H+����С���ʴ�Ϊ��HC1O��
��2�����н�ǿ�Ļ�ԭ�ԡ�H3PO3�ĵ��뷽��ʽΪH3PO3 ![]() H2PO3-+H+��H2PO3-
H2PO3-+H+��H2PO3-![]() HPO32-+H+����������H3PO3��Ϊ��Ԫ�ᣬNa2HPO3�����Σ��ʴ�Ϊ��H3PO3
HPO32-+H+����������H3PO3��Ϊ��Ԫ�ᣬNa2HPO3�����Σ��ʴ�Ϊ��H3PO3 ![]() H2PO3-+H+��H2PO3-
H2PO3-+H+��H2PO3-![]() HPO32-+H+;����
HPO32-+H+;����
��3�������£���ˮϡ��0.1mol/L��CH3COOH��Һ�ٽ�����ĵ��룬���������������⣬��Ҫ���ӵ�Ũ�Ȼ��С��A��ϡ�ͺ�c��H+����С��B����ˮϡ��0.1mol/L��CH3COOH��Һ�ٽ�����ĵ��룬�����ӵ����ʵ�����������ӵ����ʵ�����С��![]() ����C��ϡ�ͺ�c��CH3COO- �� ��С��D��ϡ�ͺ�c��CH3COOH����С����ѡB��
����C��ϡ�ͺ�c��CH3COO- �� ��С��D��ϡ�ͺ�c��CH3COOH����С����ѡB��
��4������ͼ�����֪������ʼ��������Һ��c��H+����ͬ��c������������c����ǿ������ϡ�����н�����ĵ���̶�����������ϡ�����н������c��H+��һֱ���ڽ�ǿ���c��H+����ϡ����ͬ������HX��pH�仯��CH3COOH�Ĵ�HX����ǿ������ƽ�ⳣ���ʴ�Ϊ�����ڣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ��Ԫ�����ڱ���һ���֣���ش��������⡣
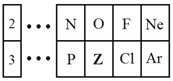
��1��ZԪ����Ԫ�����ڱ���λ�ڵ�________�塣
��2��Z��ԭ�Ӱ뾶__________������ڡ�����С�ڡ����ڡ���Si��ԭ�Ӱ뾶��
��3��ClԪ�صķǽ����Ա�ZԪ�ص�__________���ǿ������������
��4��ZԪ�ص���̬�⻯��Ļ�ѧʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̼����������ЧӦ������Ҫ���ʣ�Ӧ�ü��ٶ�����̼���ŷš�
��1����һ����CO2�����״�ȼ�ϵķ�����
��֪��CO2��g��+3H2��g���TCH3OH��g��+H2O��g����H=-a kJmol-1��
CH3OH��g���TCH3OH��l����H=-b kJmol-1��
2H2��g��+O2��g���T2H2O��g����H=-c kJmol-1��
H2O��g���TH2O��l����H=-d kJmol-1��
���ʾCH3OH��l��ȼ���ȵ��Ȼ�ѧ����ʽΪ��_______________��
��2����һ���¶��µ�2L�̶��ݻ����ܱ������У�ͨ��2mol CO2��3mol H2�������ķ�ӦΪ��CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g����H<0�����CO2��g����CH3OH��g����Ũ����ʱ��仯����ͼ��ʾ��
CH3OH��g��+H2O��g����H<0�����CO2��g����CH3OH��g����Ũ����ʱ��仯����ͼ��ʾ��
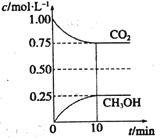
�ٴ�0min��10min��v��H2��=______��
�����д�ʩ����ʹ![]() �������______��ѡ3���ţ���
�������______��ѡ3���ţ���
A�������¶� B�����º����³���He��g��
C����H2O��g������ϵ�з��� D�����º����ٳ���2mol CO2��3mol H2
�ۼ�����¶��´˷�Ӧ��ƽ�ⳣ��K=______�������������λ��Ч���֣������ı�______���������ţ�����ʹK=1��
A������ѹǿ B������Ӧ��Ũ�� C�������¶� D�������¶� E���������
��3��ij�״�ȼ�ϵ��ԭ����ͼ1��ʾ
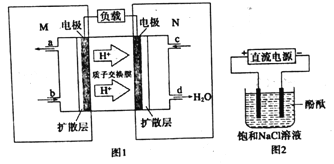
����M�������ĵ缫��ӦʽΪ______��
���������������Դ����ͼ2װ�õ�ⱥ��ʳ��ˮ���缫��Ϊ���Ե缫������õ�ⷴӦ���ܷ�Ӧ�����ӷ���ʽΪ��__________________��
������Һ���Ϊ300mL������Һ��pHֵΪ13ʱ���������²ⶨ�������������ļ״�������Ϊ______��������Һ����仯����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧʽΪC7H16�������У��ڽṹʽ�к���3������ͬ���칹����Ŀ�ǣ� ��
A.2
B.3
C.4
D.5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��W��X��Y��ԭ��������������P��n��m�ֱ���Ԫ��W��X��Y�ĵ��ʣ�r��q������ЩԪ����ɵĶ�Ԫ�����r��һ�ֵ���ɫ��ĩ��������0.01mol/L s��Һ��pHΪ 12���������ʵ�ת����ϵ��ͼ��ʾ������˵����ȷ����
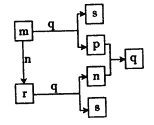
A. ���Ӱ뾶:Y>X
B. ��ԭ��:m>p
C. r��s��q�о��������Ӽ�
D. 1 mol p������n��Ӧ������̬q���ų�������ΪP��ȼ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ��R��T��X��Y��Z��Ԫ�����ڱ��е����λ������ͼ��ʾ������Z������H2�����ǿ��ᷢ����ը���������жϴ������
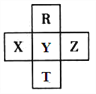
A. ԭ�Ӱ뾶 Z��Y��R
B. R��Y�ĵ��������8
C. �ǽ����ԣ�Z��Y��X
D. HZO4��Ŀǰ��������ǿ�ĺ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�Ũ�Ⱦ�Ϊ0.2 mol/L��HA��BOH��Һ�������Ϻ�������Һ�в���������ּ�Ũ����ͼ��ʾ������˵���в���ȷ����
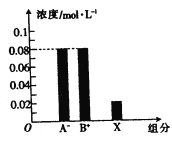
A��HA��BOH��Ϊ������� B�� X��ʾHA��BOH����
C�� ���볣�� K��HA��=K��BOH�� D��������ҺpH=4.53
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������µĶ����ܱ������У�������Ӧ2SO2(g)+ O2(g) ![]() 2SO3(g), ��������������ܱ�����Ӧ�ﵽƽ��״̬
2SO3(g), ��������������ܱ�����Ӧ�ﵽƽ��״̬
A. SO3������ٷֺ������ֲ���
B. SO2������O2���ʵ�2��
C. SO3��Ũ����O2Ũ�ȵ�2��
D. ��λʱ����SO2���ĵ�Ũ�ȵ���SO3���ɵ�Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������̶����ܱ������У����п��淴ӦA(s)+3B(g)![]() 3C (g) �����������б����ÿ��淴Ӧһ���ﵽƽ��״̬����
3C (g) �����������б����ÿ��淴Ӧһ���ﵽƽ��״̬����
��C������������C�ķֽ�������ȣ�����λʱ��������amol A��ͬʱ����3amol B��
��B��Ũ�Ȳ��ٱ仯�� ����������ܵ����ʵ������ٷ����仯��
��A��B��C�����ʵ���֮��Ϊ1:3:3�� �����������ܶȲ��ٱ仯��
A. �٢ۢ� B. �٢ۢܢ� C. �٢ڢ� D. �٢ۢܢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com