
同一主族的两种元素的原子序数之差不可能的是
| A.16 | B.26 | C.36 | D.46 |
科目:高中化学 来源: 题型:填空题
Ⅰ:某些化学反应可表示为:A+B→C+D+H2O,请回答下列问题:
(1)若A、C、D均是铁的化合物,B是稀硫酸,则A与B反应的化学方程式为
(2)若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,该反应离子方程式为 。
(3)若A为淡黄色固体,C为无色的气体,则该反应的离子方程式为 。
Ⅱ:某些化学反应可表示为:A+NaOH+H2O→C+D。请回答下列问题:
(1)若A为金属单质,C为非金属单质,写出符合要求的离子方程式_____________________
(2)若A为非金属单质,C为非金属单质,写出符合要求的化学反应方程式
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙、丙、丁、X是由短周期元素组成的纯净物,其中X为单质。上述物质转化关 系如下图所示(某些产物略去)。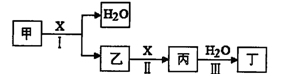
请回答下列问题:
(1)若丁是一元强酸,甲→丁是工业生产丁的主要途径。
①写出反应I的化学方程式: 。
②常温下,1 mol丙发生反应III放出46kJ热量,该反应的热化学方程式为: 。
③在常温下,向V1L pH= 11的甲溶液中加入V2L pH=3的盐酸,若反应后溶液的pH<7,则V1和V2的关系为V1 V2(选填“>”、“<”或“=”),所得溶液中各种离子的浓度由大到小的顺序可能是: (写一种即可)。
(2)若丁是二元弱酸,丙是温室气体。
在容积为2L的容积固定的密闭容器中,将乙(g)和H2O(g)按下表用量分别进行反应:乙(g)+H2O(g)  丙(g) + H2(g),得到如下数据:
丙(g) + H2(g),得到如下数据: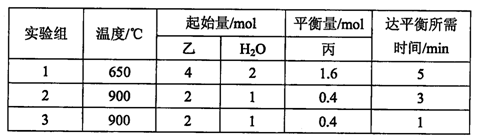
①该反应的正反应为 (填“吸热”或“放热”)反应。
②900℃时,上述反应按如下起始量分别加入该容器:
则此时反应的v(正) v(逆)(填“>”、“<”或“=”)。
③实验3跟实验2相比,改变的条件可能是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业。为生成氮化硅膜,可以用NH3和SiH4(硅烷)在一定条件下反应并在600℃的加热基板上生成氮化硅膜:
3 SiH4+4NH3 Si3N4+12H2
Si3N4+12H2
(1)以硅化镁为原料制备硅烷的反应和工业流程如下:
反应原理:4NH4Cl+Mg2Si 4NH3↑+SiH4↑+2MgCl2(△H < 0)
4NH3↑+SiH4↑+2MgCl2(△H < 0)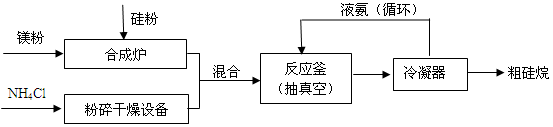
①NH4Cl的化学键类型有____________,SiH4电子式为_______________。
②上述生产硅烷的过程中液氨的作用是________________________。
③氨气也是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式_______,实验室可利用如图所示装置完成该反应。 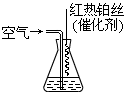
在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是_____________。
(2)三硅酸镁(Mg2Si3O8?nH2O)难溶于水,在医药上可做抗酸剂。它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为_______________________________。将0.184 g三硅酸镁加到50 mL 0.1 mol/L盐酸中,充分反应后,滤去沉淀,以甲基橙为指示剂,用0.1 mol/L NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30 mL,则Mg2Si3O8?nH2O的n值为_________。(注:Mg2Si3O8的摩尔质量为260 g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关物质性质的比较正确的是
①同主族元素的单质从上到下,非金属性减弱,熔点增高
②元素的最高正化合价在数值上等于它所在的族序数
③同周期主族元素的原子半径越小,越难失去电子
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤还原性:S2->Se2->Br->Cl-
⑥酸性:HClO4>H2SO4>H3PO4>H2SiO3
| A.①③ | B.②④ | C.③⑥ | D.⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关叙述正确的是( )
A. O和 O和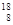 O中子数相同,质子数不同,互为同位素 O中子数相同,质子数不同,互为同位素 |
| B.H2O比H2S稳定,H—S键比H—O键更难断裂 |
| C.Na2O晶体中存在离子键,是离子化合物 |
| D.Na2O2晶体中阳离子与阴离子个数比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列结论正确的是 ( )
①粒子半径:K>Cl>S ②氢化物稳定性:HF>H2S>PH3;
③离子还原性:S2->Cl->Br->I- ④单质氧化性:Cl2>S>Si;
⑤酸性:H2SO4>HClO ⑥碱性强弱:KOH>NaOH>Mg(OH)2
| A.①④⑤ | B.③⑥ | C.②④⑤⑥ | D.①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( ) 
| A.原子半径:Z>Y>X |
| B.气态氢化物的稳定性:W > R |
| C.WX3和水反应形成的化合物是离子化合物 |
| D.Y和Z两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com