
Ⅰ:某些化学反应可表示为:A+B→C+D+H2O,请回答下列问题:
(1)若A、C、D均是铁的化合物,B是稀硫酸,则A与B反应的化学方程式为
(2)若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,该反应离子方程式为 。
(3)若A为淡黄色固体,C为无色的气体,则该反应的离子方程式为 。
Ⅱ:某些化学反应可表示为:A+NaOH+H2O→C+D。请回答下列问题:
(1)若A为金属单质,C为非金属单质,写出符合要求的离子方程式_____________________
(2)若A为非金属单质,C为非金属单质,写出符合要求的化学反应方程式
(其它合理也可)
Ⅰ(1)Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O
(2)Cl2+2OH-=Cl-+ClO-+H2O
(3)2Na2O2+4H+=O2↑+4Na+ +2H2O
Ⅱ(1)2Al+2OH-+2H2O= 2AlO2-+3H2↑
(2)Si+2NaOH+H2O= Na2SiO3+2H2↑
解析试题分析:Ⅰ(1)分析反应特点,结合A、C、D均是铁的化合物,可知A是Fe3O4,则A与B反应的化学方程式为: Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O
(2)A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,猜想A是氯气,与碱液的反应,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O
(3)A为淡黄色固体,则A为过氧化钠,产物有三种,可考虑为过氧化钠与酸的反应,离子方程式为:2Na2O2+4H+=O2↑+4Na+ +2H2O
Ⅱ根据反应特点,与氢氧化钠溶液反应的单质中有铝、硅,
(1)A为铝,离子方程式为2Al+2OH-+2H2O= 2AlO2-+3H2↑;
(2)A为硅,化学方程式为Si+2NaOH+H2O= Na2SiO3+2H2↑
考点:考查对化学方程式的特点的分析能力、对某些特殊物质的化学性质的熟悉度


科目:高中化学 来源: 题型:单选题
下列实验操作及现象能够达到对应实验目的的是
| 选项 | 实验操作及现象 | 实验目的 |
| A | 将SO2通入品红溶液中,品红溶液褪色;加热褪色后的品红溶液,溶液恢复红色 | 验证亚硫酸的不稳定性 |
| B | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生 | 证明常温下 Ksp(BaCO3)>Ksp(BaSO4) |
| C | 常温下,测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水溶液中HCl电离程度大于CH3COOH |
| D | 将浓硫酸与碳混合加热,直接将生成的气体通入足量的石灰水,石灰水变浑浊 | 检验气体产物中CO2的存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
稀土元素是周期表中Ⅲ B族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。其中钇(Y)元素是激光和超导的重要材料。
我国蕴藏着丰富的钇矿石( Y2 FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下: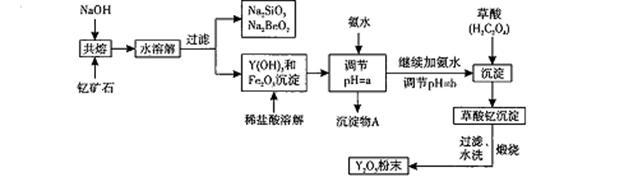
已知:
I.有关金属离子形成氢氧化物沉淀时的pH如下表:
| | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰的常见流程如下: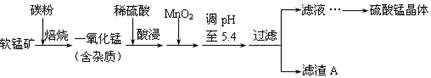
部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化工生产中常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)“三酸”与“两碱”之间均可反应,酸过量时, 若用化学方程式表示有六个,若用离子方程式表示却只有两个,一个是H++OH-=H2O,请写出另一个离子方程式: 。
(2) 实验室制备H2、CO2、NH3、SO2时,用盐酸和稀硫酸可制备的相同气体是_______。
(3)烧碱、纯碱溶液均可吸收CO2,当含0.1 mol NaOH的溶液吸收一定量CO2后,将溶液低温小心蒸干得到固体的组成可能有四种情况,分别是(填化学式):
① ;②Na2CO3;③Na2CO3和NaHCO3;④NaHCO3。
(4)将(3)得到的固体重新溶解于水,向其中加入盐酸,调节溶液的pH恰好等于7,再将溶液蒸干,最终得到固体的质量为 g。
(5)利用侯德榜制碱法可制两碱的一种,请写出制取小苏打时在溶液中发生反应的总化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某含氯化合物A由两种短周期元素组成,常温下该物质为气态,测得该气体对空气的相对密度为3.0,A溶于水可得只含单一溶质B的弱酸性溶液,B溶液在放置过程中其酸性会增强。常温下,气体A与NH3反应生成离子晶体C、气体单质D和常见液体E,D为空气中含量最多的物质。气体A可用某一气体单质与潮湿的Na2CO3反应制得,同时生成两种钠盐。请回答下列问题:
(1)气体A的化学式为 ,气体单质D对应元素在周期表中的位置为 。
(2)用化学方程式表示B溶液酸性增强的原因 。
(3)气体A与NH3反应的化学方程式为 ,该反应体现气体A具有 性。
(4)试写出制取气体A的化学方程式为 。
(5)设计实验探究离子晶体C的成分为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(11分)由C、Cu、FeCO3、铜锈[主要成分为Cu2(OH)2CO3]组成的固体混合物,进行了如下所示的实验过程: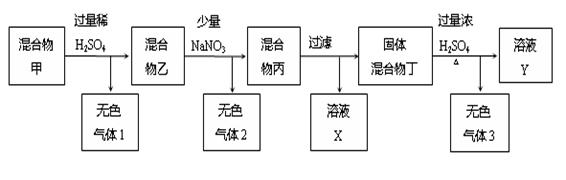
回答下列问题:
(1)无色气体1的成分是: 。
(2)混合物乙中加入NaNO3后,写出一个可能产生无色气体2的反应的离子方程式:
(3)溶液X中含有的金属阳离子是 。
(4)无色气体3成分是 ,已知固体混合物丁的的质量为5.6g,在标准状况下无色气体3的体积为14.56L,求无色气体3各成分的物质的量: 。(写出具体的计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl?、OH?、NO3?、CO 、X中的一种。
、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是
(填化学式);
(2)为了确定X,现将(1)中的两种物质记为A和B,当C与B的溶液混合时,产生红褐色沉淀和无色无味气体;当C与A的溶液混合时产生棕灰色沉淀,向该沉淀中滴入稀HNO3,沉淀部分溶解,最后留有白色沉淀不再溶解。则:
①X为 ;
A.SO B.SO
B.SO C.CH3COO D.SiO
C.CH3COO D.SiO
②A中的化学键类型为 ;
③将0.02 mol的A与0.01mol的C同时溶解在足量的蒸馏水中,充分反应后,最终所得沉淀的质量为 (精确到0.1g);
④利用上述已经确定的物质,可以检验出D、E中的阳离子。请简述实验操作步骤、现象及结论 ;
(3)将Cu投入到装有D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,则该反应的离子方程式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com