
有A、B、C、D、E五种短周期的主族元素,其原子序数依次增大.其中只有C是金属,D的单质是黄色固体,A、B、D在周期表中的相对位置关系如题6图.下列说法正确的是

A.E元素位于周期表中的第三周期、ⅥA族
B.B的简单阴离子比D的简单阴离子还原性强
C.B与C形成的化合物中一定含有共价键
D.A、B两元素形成的常见化合物的分子构型均为直线型
D
【解析】
试题分析:根据题意知,A、B、C、D、E五种短周期的主族元素,D的单质是黄色固体,则D为硫元素;根据元素周期表的结构和A、B、D在周期表中的相对位置关系判断,A为碳元素,B为氧元素;又A、B、C、D、E原子序数依次增大,则E为氯元素;C是金属,则C可能为Na、Mg、Al中的一种。A、E为氯元素,位于周期表中的第三周期、ⅦA族,错误;B、非金属性O>S,元素的非金属性越强,对应的简单阴离子的还原性越弱,错误;C、B氧元素,C可能为Na、Mg、Al,B与C形成的化合物中一定含有离子键,错误;D、C、O两元素形成的常见化合物分别为CO、CO2,都为直线形分子,正确。
考点:考查元素推断、元素周期律及相关物质的结构和性质。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源:2013-2014重庆市下学期期中考试高一化学试卷(解析版) 题型:选择题
下列过程中没有破坏化学键的是( )
A.氯化氢溶于水 B.氯化铵分解 C.食盐熔化 D.干冰升华
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市高三5月月考理综化学试卷(解析版) 题型:选择题
下列推论正确的是:
A.S(g)+O2(g)==SO2(g)△H1;S(s)+O2(g)==SO2(g) △H2,则:△H1>△H2
B.C(石墨,s)=C(金刚石,S)△H=+1.9 kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(I)△H=﹣57.4 kJ/mol,则:含20 gNaOH的稀溶液与稀盐酸完全反应,放出的热量为28.7 kJ
D.2C(s)+O2(g)=2CO(g)△H=﹣221 kJ/mol,则碳的燃烧热等于110.5kJ/mol
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市主城七区高三下学期第二次联考理综化学试卷(解析版) 题型:选择题
下列叙述中,不正确的是
A.pH=2与pH=1的CH3COOH溶液中,c(H+)之比为1 :10
B.1.0mol/ L的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
C.仅含Na+、H+、OH-、CH3COO-离子的某溶液中可能存在:
c(Na+)>c(CH3COO-) >c(OH-)>c(H+)
D.0.1mol/ L的CH3COOH溶液中,由水电离出的c(H+)为1×10-13mol/ L
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期高三第二次诊断测试理科综合化学试卷(解析版) 题型:填空题
(15分)甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____________分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)  CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为____________
②下列选项能判断该反应达到平衡状态的依据的有____________
A.2v(H2)=v(CH3OH) B.CO的消耗速率等于CH3OH的生成速率
C.容器内的压强保持不变 D.混合气体的密度保持不变
E.混合气体的颜色保持不变 F.混合气体的平均相对分子质量不随时间而变化
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣akJ·mol﹣1
②2CO(g)+O2(g)=2CO2(g) △H=﹣bkl·mol﹣1
③H2O(g)=H2O(1) △H=﹣ckJ·mol﹣1
则CH3OH(1)+O2(g)==CO(g)+2H2O(1) △H=____________kJ·mol﹣1
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为____________________________________.
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
c/mol·L﹣1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____________.
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期高三第二次诊断测试理科综合化学试卷(解析版) 题型:选择题
下列排列顺序不正确的是
A.熔点:Al>K>Na B.微粒的半径:Cl﹣>Na+>Mg2+>A13+
C.热稳定性:HF>HCl>HBr>HI D.仅结合质子能力:AlO2﹣>CO32﹣>F﹣
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市万州区高三考前模拟理综化学化学试卷(解析版) 题型:选择题
某小分子抗癌药物的分子结构如图所示,下列说法正确的是
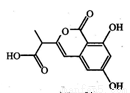
A.1mol该有机物最多可以和5mol NaOH反应
B.该有机物容易发生加成、取代、中和、消去等反应
C.该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色
D.1mol该有机物与浓溴水反应,最多消耗3mol Br2
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:填空题
(12 分)(原创)部分弱酸的电离平衡常数如表:
弱酸 | HCOOH | HNO2 | H2S | H2SO3 | H2C2O4 |
电离平衡常数 (25℃) | K=1.8×10﹣4 | K=5.1×10﹣4 | K1=9.1×10﹣8 K2=1.1×10﹣12 | K1=1.23×10﹣2 K2=6.6×10﹣8 | K1=5.4×10﹣2 K2=5.4×10﹣5 |
(1)请写出HNO2的电离方程式
(2)上表的5种酸进行比较,酸性最弱的是:_______________;HCOO-、S2-、HSO3- 3种离子中,最难结合H+的是 。
(3)在浓度均为0.1mol/L的HCOOH和H2C2O4混合溶液中,逐渐滴入0.1mol/L的NaOH溶液,被OH—先后消耗的酸及酸式酸根依次是:_______________________。
(4)已知HNO2具有强氧化性,弱还原性。将HNO2溶液滴加到H2S溶液中,同时有沉淀和无色气体生成,该气体遇空气立即变为红棕色,试写出两酸之间的化学反应方程式:_____________________________________________。
(5)下列离子方程式书写正确的是
A.HNO2 + HS— == NO2—+ H2S↑
B.2HCOOH+SO32— == 2HCOO—+H2O+SO2↑
C.H2SO3+2HCOO— == 2HCOOH+SO32—
D.H2SO3+ SO3 2— == 2HSO3—
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.能溶解Al2O3的溶液:Na+、K+、HCO3-、NO3-
B.0.1mol·L-1Ca(ClO)2溶液:K+、Na+、I-、Cl-
C.能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO3-
D.加入KSCN显红色的溶液:Na+、Mg2+、Cl-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com