
【题目】以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠的工艺流程如图: 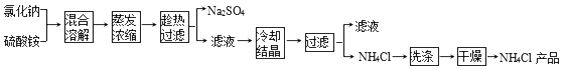
【查阅资料】
①上述流程所示物质中只有NH4Cl受热易分解:NH4Cl ![]() NH3↑+HCl↑
NH3↑+HCl↑
②氯化铵和硫酸钠的溶解度随温度变化曲线如图所示: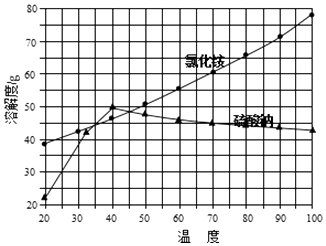
请回答下列问题:
(1)写出氯化钠和硫酸铵溶液混合得到硫酸钠晶体的化学方程式: .
(2)欲制备10.7g NH4Cl,理论上需NaCl质量为g.
(3)实验室进行蒸发结晶用到的主要仪器除铁架台、铁圈、酒精灯外,还要有 .
(4)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 .
(5)不用其它试剂,检查NH4Cl产品是否纯净的方法:
操作步骤 | 现象 | 结论 |
取少量氯化铵产品于试管底部, | 表明氯化铵产品纯净 |
【答案】
(1)(NH4)2SO4+2NaCl═2NH4Cl↓+Na2SO4
(2)11.7
(3)玻璃棒、烧杯、蒸发皿
(4)35℃
(5)加热;如果试管底部没有固体剩余
【解析】解:将氯化钠和硫酸铵混合溶解,蒸发浓缩,根据溶解度曲线可知,在温度较高时,硫酸钠溶解度较小,所以趁热过滤可得硫酸钠固体,溶液中则主要为氯化铵,过滤得氯化铵溶液,将氯化铵溶液冷却结晶,过滤得氯化铵固体,经洗涤干燥得氯化铵产品,(1)硫酸铵和氯化钠相互交换离子生成硫酸钠和氯化铵,反应方程式为(NH4)2SO4+2NaCl═2NH4Cl↓+Na2SO4,
故答案为:(NH4)2SO4+2NaCl═2NH4Cl↓+Na2SO4;(2)10.7g NH4Cl的物质的量为 ![]() =0.2mol,根据Cl元素守恒,需要NaCl的物质的量也为0.2mol,质量为0.2mol×58.5g/mol=11.7g,
=0.2mol,根据Cl元素守恒,需要NaCl的物质的量也为0.2mol,质量为0.2mol×58.5g/mol=11.7g,
故答案为:11.7;(3)实验室进行蒸发结晶用到的主要仪器除铁架台、铁圈、酒精灯外,还需要蒸发溶液的蒸发皿、盛放晶体的烧杯、搅拌用的玻璃棒,
故答案为:蒸发皿、烧杯、玻璃棒;(4)根据硫酸钠的溶解度曲线不难看出,在低于40℃时,硫酸钠的溶解度随温度的升高而增大,高于40℃时硫酸钠的溶解度随温度的升高而减小;由两物质的溶解度曲线不难看出,只有在35~45℃时,氯化铵的溶解度小于硫酸钠的溶解度,
故答案为:35℃;(5)加热条件下氯化铵分解生成氨气和氯化氢,如果固体完全是氯化铵,则加热后没有固体剩余,如果有固体剩余就证明氯化铵不纯净,所以其检验方法为:取少量氯化铵产品于试管底部,加热,如果试管底部没有固体剩余,就说明氯化铵纯净,
故答案为:加热;如果试管底部没有固体剩余.
将氯化钠和硫酸铵混合溶解,蒸发浓缩,根据溶解度曲线可知,在温度较高时,硫酸钠溶解度较小,所以趁热过滤可得硫酸钠固体,溶液中则主要为氯化铵,过滤得氯化铵溶液,将氯化铵溶液冷却结晶,过滤得氯化铵固体,经洗涤干燥得氯化铵产品,(1)硫酸铵和氯化钠相互交换离子生成硫酸钠和氯化铵;(2)根据Cl元素守恒计算NaCl的质量;(3)实验室进行蒸发结晶用到的主要仪器除铁架台、铁圈、酒精灯外,还需要蒸发皿、玻璃棒、烧杯;(4)从溶解度曲线判断硫酸钠和氯化铵的溶解度变化特点分析,在35﹣45℃时,氯化铵的溶解度小于硫酸钠的溶解度;(5)氯化铵分解生成氯化氢和氨气,根据固体加热是否有剩余固体确定氯化铵是否除净.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A.淀粉和油脂的水解都是高分子生成小分子的过程
B.2﹣甲基丙烷和异丁烷互为同系物
C.![]() 属于取代反应
属于取代反应
D.C3H4Cl2的链状有机物的同分异构体有5种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是( )
A. E(5s)>E(4f)>E(4s)>E(3d)
B. E(3d)>E(4s)>E(3p)>E(3s)
C. E(4s)<E(3s)<E(2s)<E(1s)
D. E(5s)>E(4s)>E(4f)>E(3d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若将海水淡化作饮用水使用,下列方法在原理上完全不可行的是
A. 利用太阳能使海水蒸馏淡化
B. 加明矾使海水中的盐分沉淀而淡化
C. 利用电渗析法可以获取淡化的饮用水
D. 将海水通过离子交换树脂,以除去所含离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(结构如图)的下列叙述中:①能使酸性KMnO4溶液褪色;②可发生加聚反应;③可溶于水;④可溶于苯中;⑤能与浓硝酸发生取代反应;⑥所有的原子可能共平面,其中正确的是( ) ![]()
A.仅①②④⑤
B.仅①②⑤⑥
C.仅①②④⑤⑥
D.全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是中学化学中四种常见的物质,其转化关系如图所示.则甲和X不可能是( ) 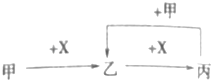
A.甲为CO2 , X为NaOH溶液
B.甲为NH3 , X为O2
C.甲为Si,X为O2
D.甲为NaAlO2 , X为HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种黄绿色气体.1974年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;通常也可用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O;
MnCl2+Cl2↑+2H2O;通常也可用高锰酸钾和浓盐酸混合来制取氯气:2KMnO4+16HCl(浓)═2MnCl2+5Cl2↑+2KCl+8H2O;
(1)若用这两种方法制氯气,请比较,它们的发生装置使用的不同仪器是 .
(2)现将29g纯度为60%的软锰矿(主要成分MnO2)与足量的浓盐酸充分反应(杂质不参加反应),把反应后所得溶液稀释到200mL.计算: ①生成的Cl2在标准状况下的体积.
②稀释后溶液中MnCl2的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
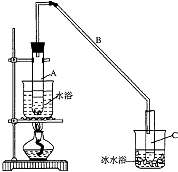
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯 已知: 
密度(g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
环已醇 | 0.96 | 25 | 161 | 能溶于水 |
环已烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品 将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是 , 导管B除了导气外还具有的作用是 .
②试管C置于冰水浴中的目的是 .
(2)制备精品 ①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在层(填上或下),分液后用(填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯蒸馏即可得到精品.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成实验Fe与水蒸气反应,如图所示. 
(1)装置A的作用是 .
(2)B中反应的化学方程式: .
(3)碱石灰的作用是 .
(4)在D处玻璃管口点燃生成的气体前,必须对该气体进行 , 这一操作的目的是 .
(5)当有16.8g 铁粉参加反应时,生成的气体在标准状况下的体积是 L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com