
【题目】研究电化学原理与应用有非常重要的意义。
(1)锌锰电池(俗称干电池) 是一种一次电池,生活中应用广泛。
①锌锰电池负极上的电极反应式为:______________________________。
②与普通(酸性)锌锰电池相比较,碱性锌锰电池的优点是____________________(回答一条即可)。
(2)铅蓄电池是最常见的二次电池:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。
2PbSO4+2H2O。
①充电时阴极反应为:________________________________________。
②用铅蓄电池为电源进行电解饱和食盐水实验(石墨棒为阳极,铁为阴极,食盐水500mL,温度为常温),当电路中有0.05mol电子转移时,食盐水的pH为______(假设溶液体积不变,产物无损耗)。
(3)图1是金属(M)-空气电池的工作原理,我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,电池反应为:___________________________ 。

二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图2所示。Pt2上的电极反应式为:_______________________________________ 。
(4)高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂,可以用电解法制取:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图所示。
FeO42+3H2↑,工作原理如图所示。

装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。电解一段时间后,c(OH)降低的区域在_____________(填“阴极室”或“阳极室”);阳极反应为:___________________________。
【答案】Zn-2e-=Zn2+ 比能量高(或可存储时间长、不易发生电解质的泄漏、或碱性电池使用寿命较长其他合理答案也可) PbSO4+2e-=Pb+SO42- 13 4Al+3O2+6H2O=4Al(OH)3 O2+4H++4e-=2H2O 阳极室 Fe+8OH--6e-=FeO42+4H2O
【解析】
(1)①锌锰电池中,锌的活泼性大,做负极;
②碱性锌锰电池比普通锌锰电池性能好,比能量和可储存时间均有提高,据此分析作答;
(2)①充电过程为电解池原理,其阴极得电子,被还原;
②电解饱和食盐水时,阳极氯离子失电子生成氯气,阴极氢离子得电子变为氢气,根据电子转移数与物质之间的关系式计算溶液中氢氧根浓度,进而求出pH;
(3)电池工作时,负极为Al,发生氧化反应,电极反应式为Al-3e-+3OH-=Al(OH)3,正极上通入空气,发生还原反应,正极反应式为O2+2H2O+4e-=4OH-,进而写出总反应式;二氧化硫—空气质子交换膜燃料电池中,Pt2电极上通入的是氧气与水,发生还原反应,电解质为质子交换膜,据此分析作答;
(4)用电解法制备高铁酸钠,电解时阳极区铁失去电子发生氧化反应,结合氢氧根离子生成高铁酸根离子和水,据此分析作答。
(1)①在锌锰干电池中,锌做负极,其电解反应式为:Zn-2e-=Zn2+,
故答案为:Zn-2e-=Zn2+;
②碱性锌锰电池的优点是比能量高、可存储时间长、不易发生电解质的泄漏等,
故答案为:比能量高(或可存储时间长、不易发生电解质的泄漏、或碱性电池使用寿命较长其他合理答案也可);
(2)①电解质溶液为硫酸,根据总反应式可知,在阴极区,硫酸铅得电子转化为铅,其电极反应式为:PbSO4+2e-=Pb+SO42-,
故答案为:PbSO4+2e-=Pb+SO42-;
②电解饱和食盐水发生的总反应为:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,2NaOH
2NaOH+H2↑+Cl2↑,2NaOH![]() H2
H2![]() 2e-,则0.05mol电子转移时,n(OH-) = 0.05 mol,故c(OH-) =
2e-,则0.05mol电子转移时,n(OH-) = 0.05 mol,故c(OH-) = ![]() = 0.1 mol/L,pH =-lg
= 0.1 mol/L,pH =-lg ![]() = 13,
= 13,
故答案为:13;
(3)该电池中,负极为Al,正极通入空气,总反应式为:4Al+3O2+6H2O=4Al(OH)3;二氧化硫—空气质子交换膜燃料电池中,Pt2电极为电源的正极,结合质子交换膜可知,发生的电极反应式为:O2+4H++4e-=2H2O,
故答案为:4Al+3O2+6H2O=4Al(OH)3;O2+4H++4e-=2H2O;
(4)用铁做阳极电解氢氧化钠制备高铁酸钠,阳极室铁失去电子,发生氧化反应,结合氢氧根离子生成高铁酸根离子和水,则电解一段时间后,c(OH)降低的区域在阳极室,电极反应式为:Fe+8OH--6e-=FeO42+4H2O;
故答案为:阳极室;Fe+8OH--6e-=FeO42+4H2O;


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列生产或实验事实引出的相应结论不正确的是( )
选项 | 事实 | 结论 |
A | 工业制硫酸中,在矿石处理阶段,将矿石粉碎再煅烧 | 增大反应物的接触面积,加快化学反应速率 |
B | A、B两支试管中分别加入等体积5%的H2O2,在B试管中加入MnO2,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
C | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
D | 一定条件下:H2(g)+I2(g) | c(I2)增大,I2物质的量增多 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见烃,是一种水果催熟剂;草莓、香蕉中因为含有F而具有芳香味。现以A为主要原料合成F,其合成路线如下图所示。

(1)A的结构简式为____;D中官能团名称为____。
(2)写出反应①的化学方程式:____________________。
(3)写出反应②的化学方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯与一卤代烷在催化剂作用下可生成苯的同系物:![]() +CH3X→
+CH3X→![]() +HX,在催化剂存在下,由苯和下列各组物质合成乙苯最好应选用的是
+HX,在催化剂存在下,由苯和下列各组物质合成乙苯最好应选用的是
A.CH2=CH2和HClB.CH3CH3和I2
C.CH2=CH2和Cl2D.CH3CH3和HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,错误的是

A. 用装置①在铁上镀锌,则a为铁,b为锌
B. 装置②的总反应是:Fe+2Fe3+=3Fe2+
C. 装置③的反应实质是电解水
D. 装置④中开关由M改置于N时,Cu—Zn合金的腐蚀速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定某盐A(仅含三种元素)的组成,某研究小组按如图流程进行了探究:

请回答:
(1)A的化学式为______________________。
(2)固体C与稀盐酸反应的离子方程式是________________________。
(3)A加热条件下分解的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1871年门捷列夫最早预言了类硅元素锗,锗元素在元素周期表中与硅元素同族,并位于硅的下一周期。1886年德国化学家温克勒发现和分离了锗元素,并以其祖国的名字命名为“Ge”。锗是重要的的半导体材料,其有机化合物在治疗癌症方面有着独特的功效。
已知:①丹宁是一种有机沉淀剂,可与四价锗络合形成沉淀:
②GeCl4易水解,在浓盐酸中溶解度低。
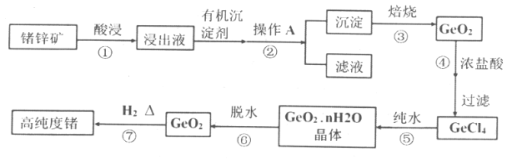
(1)锗元素的原子序数为:___________;锗元素在元素周期表中的位置是:_____________。
(2)GeCl4的结构与SiCl4相似,写出GeCl4的电子式:_______________。
(3)简述步骤①中提高酸浸效率的措施____________、_____________(写两种)。
(4)步骤②操作A是___________(填操作名称)。
(5)步骤③中的物质在___________(填仪器名称)中加热。
(6)步骤④不选用稀盐酸,而选用浓盐酸的原因可能是__________、________(写出两点)。
(7)写出步骤⑤的化学方程式________________。
写出步骤⑦的化学方程式________________。
(8)请写出一种证明步骤⑦反应完全的操作方法__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:3A(g)+B(g)=2C(g)+2D(g),在不同条件下,用不同物质表示其反应速率,分别为:
①v(A)=0.6 mol· L-1·min-1 ②v(B)=0.45 mol· L-1·min-1
③v(C)=0.015 mol· L-1·min-1 ④v(D)=0.45 mol· L-1·min-1
则此反应在不同条件下进行最快的是
A.③B.①C.②D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,在4L密闭容器中,某反应中的气体M和气体N的物质的量随时间变化的曲线如图所示:

(1)t1时刻N的转化率为____________。
(2)0~t3时间内用M表示的化学反应速率为____________mol/(L·min)。
(3)平衡时容器内气体的压强与起始时容器内压强的比值为____________。
(4)该反应的化学方程式为____________;比较t2时刻,正逆反应速率大小:v正____v逆(填“>”、“=”或“<”)。
(5)其他条件不变时,采取下列措施,反应速率的变化情况如何?保持恒温、恒容:①充入少量氦气:____________(填“增大”、“减小”或“不变”,下同);
②充入一定量的气体N:____________。
(6)下列能表示上述反应达到化学平衡状态的是____________。(填编号)
A.v逆(M)=2v正(N) B.M与N的物质的量之比保持不变
C.混合气体密度保持不变 D.容器中压强保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com