
【题目】关于下列各装置图的叙述中,错误的是

A. 用装置①在铁上镀锌,则a为铁,b为锌
B. 装置②的总反应是:Fe+2Fe3+=3Fe2+
C. 装置③的反应实质是电解水
D. 装置④中开关由M改置于N时,Cu—Zn合金的腐蚀速率减小
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生:2NO(g)+2CO(g)![]() 2CO2+N2(g)△H=-QkJ/mol,已知:c(CO2)随温度(T)、时间(t)的变化曲线如右图所示,则:
2CO2+N2(g)△H=-QkJ/mol,已知:c(CO2)随温度(T)、时间(t)的变化曲线如右图所示,则:

(1)T1___ T2 ,其理由是_________________
(2)在T2温度下,0~2s内的平均反应速率v(N2)=___
(3)在温度T3下,在两个体积均为1.0L的恒容密闭容器中发生该反应.
容器编号 | 起始物质的量 | 平衡时物质的量 |
Ⅰ | 2.0molNO,2.0molCO | 1.0molCO2 |
Ⅱ | 4.0molNO,4.0molCO |
①T3时该反应的平衡常数K=___,若起始时向容器Ⅰ中充入1.0mol NO,1.5mol CO和2.0molCO2,0.5molN2,则反应向___(填“正”或“逆”)反应方向进行。
②平衡时两容器中CO的转化率:Ⅰ___Ⅱ,容器Ⅰ中反应达平衡后,若要进一步提高CO的转化率,可采取的措施为___(答一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在周期表中的相对位置如图所示,其中Q原子的质子数是其最外层电子数的三倍。下列说法正确的是

A. 原子半径:R>T
B. 氧化物对应水化物的酸性:W>Q
C. 最简单气态氢化物的热稳定性:R>Q
D. Q与W形成的化合物中,各原子的最外层都满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 四种元素,原子序数依次增大,A 原子的最外层上有4个电子;B的阴离子和 C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)C离子的结构示意图为_____。D在周期表中位置_____。
(2)A、D两元素形成的化合物属_____(填“离子”或“共价”)化合物。
(3)写出D的最高价氧化物的水化物和A单质反应的化学方程式:_____。
(4)B原子与氢原子形成的粒子中,与NH3具有相同电子数的阴离子为_____(填化学式),阳离子为_____(填化学式),其中阴离子的电子式为_____。
(5)写出B与氯元素和氢元素形成的氯水中含有的具有漂白性物质的结构式 _____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制备氮化硅的反应为:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) ΔH<0,将0.3 mol SiCl4 和一定量 N2、H2 投入2 L反应容器,只改变温度条件测得Si3N4的质量变化如下表:
Si3N4(s)+12HCl(g) ΔH<0,将0.3 mol SiCl4 和一定量 N2、H2 投入2 L反应容器,只改变温度条件测得Si3N4的质量变化如下表:

下列说法正确的是( )
A.250 ℃,前2 min, Si3N4 的平均反应速率为0.02 mol·L-1·min-1
B.反应达到平衡时, 两种温度下 N2 和 H2 的转化率之比相同
C.达到平衡前,300 ℃条件的反应速率比250 ℃快; 平衡后,300 ℃比250 ℃慢
D.反应达到平衡时, 两种条件下反应放出的热量一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学原理与应用有非常重要的意义。
(1)锌锰电池(俗称干电池) 是一种一次电池,生活中应用广泛。
①锌锰电池负极上的电极反应式为:______________________________。
②与普通(酸性)锌锰电池相比较,碱性锌锰电池的优点是____________________(回答一条即可)。
(2)铅蓄电池是最常见的二次电池:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。
2PbSO4+2H2O。
①充电时阴极反应为:________________________________________。
②用铅蓄电池为电源进行电解饱和食盐水实验(石墨棒为阳极,铁为阴极,食盐水500mL,温度为常温),当电路中有0.05mol电子转移时,食盐水的pH为______(假设溶液体积不变,产物无损耗)。
(3)图1是金属(M)-空气电池的工作原理,我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,电池反应为:___________________________ 。

二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图2所示。Pt2上的电极反应式为:_______________________________________ 。
(4)高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂,可以用电解法制取:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图所示。
FeO42+3H2↑,工作原理如图所示。

装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。电解一段时间后,c(OH)降低的区域在_____________(填“阴极室”或“阳极室”);阳极反应为:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为分析某盐的成分, 做了如下实验:
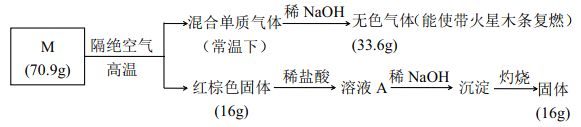
请回答:
(1)盐 M 的化学式是_________;
(2)被 NaOH 吸收的气体的电子式____________;
(3)向溶液 A 中通入H2S 气体, 有淡黄色沉淀产生, 写出反应的离子方程式________ (不考虑空气的影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.浓硫酸和浓硝酸都具有强氧化性,都能把 HCl 气体氧化
B.非金属氧化物不一定是酸性氧化物,金属氧化物多数是碱性氧化物
C.同温同压下,两份相同质量的锌粉,分别与足量的稀硫酸和浓硫酸反应,产生气体的体积相同
D.将 CO2 气体通入BaCl2 溶液中至饱和未见沉淀生成,继续通入 NH3 则有沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知:R-CH=CH-O-R′![]() R-CH2CHO + R′OH
R-CH2CHO + R′OH
(烃基烯基醚)
烃基烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3∶4 。与A相关的反应如下:
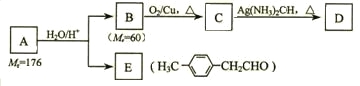
请回答下列问题:
⑴ A的分子式为_________________。
⑵ B的名称是__________;A的结构简式为_______________。
⑶写出C → D反应的化学方程式:_____________________________。
⑷写出两种同时符合下列条件的E的同分异构体的结构简式:
①属于芳香醛; ②苯环上有两种不同环境的氢原子。
_________________________、________________________。
Ⅱ.由E转化为对甲基苯乙炔(![]() )的一条路线如下:
)的一条路线如下:

⑸写出G的结构简式:___________________________。
⑹写出①-④步反应所加试剂、反应条件和①-③步反应类型:____________
序号 | 所加试剂及反应条件 | 反应类型 |
① | ||
② | ||
③ | ||
④ | —— |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com