
����Ŀ��ú��ֱ��ȼ�ջ�Դ������������Ⱦ���������γɵ�һ����Ҫԭ��ʵ��ú�������������ü�ޡ��Ҵ����״������صȾ���ú������ء�
������1����úת����ˮú������Ч�����Դ�����ʣ�
C(s)+H2O(g) ![]() CO(g)��H2(g) ��H��+131.3KJ/mol����Ӧ��ƽ�ⳣ������ʽΪK= ��
CO(g)��H2(g) ��H��+131.3KJ/mol����Ӧ��ƽ�ⳣ������ʽΪK= ��
��2��һ���¶��£�������ɱ��������Ͷ�뷴Ӧ����д˷�Ӧ��������˵����ȷ����
A����ϵ�м������(�����������ֲ���)��ƽ�ⲻ�ƶ�����Ӧ����H �����
B���������淴Ӧ��ֵ�㶨����˵��ƽ���ѽ���
C������ƽ���ѹ�������ƽ����Է�������������
D������ƽ���ѹ��ƽ�����淽���ƶ���ƽ�ⳣ����С
�����Ҵ�����Ҫ�Ļ�����Ʒ��Һ��ȼ�ϣ������������з�Ӧ��ȡ�Ҵ���
2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) ��H= a KJ/mol
CH3CH2OH(g)+3H2O(g) ��H= a KJ/mol
��һ��ѹǿ�£����������Ӧ��ʵ���������±���
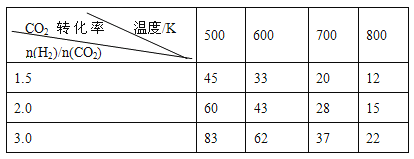
���ݱ������ݷ�����
��3��������Ӧ��a 0(����>����<������=��)
��4�����¶�ΪT1ʱ���÷�Ӧ��ƽ�ⳣ��K=1����2L�ܱ������м���һ������ϵ�����ʣ���Ӧ��ijʱ�̲�÷�Ӧ��ϵ�и������Ϊ1mol��
����ʱV(CO2)��= V(CO2)��(����>����<������=��)
������Ӧ�ں�ѹ���������н��У���ƽ���CO2�����ʵ���
A������1mol B������1mol C��С��1mol D����ȷ��
����CO2���Ǻϳ����ص���Ҫԭ�ϣ���CO2��NH3Ϊԭ�Ϻϳ�����[��ѧʽΪ[CO(NH2)2]����Ҫ��Ӧ���£���֪��
��2NH3(g)+CO2(g)=NH2CO2 NH4(s) ��H=+l59.5kJ��mol-1
��NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) ��H=+116.5kJ��mol-1
CO(NH2)2(s)+H2O(g) ��H=+116.5kJ��mol-1
��H2O(l)=H2O(g) ��H=+44.0kJ��mol-1
д��CO2��NH3�ϳ����غ�Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽ
���𰸡�
��1��[C(CO).C(H2)]/C(H2O) ����2��BC��
��3��<����4����<����D��
����2NH3(g)+CO2(g)�TCO(NH2)2(s)+H2O(l)��H=��87.0 kJ��mol��1��
��������
���������������1������C(s)+H2O(g) ![]() CO(g)��H2(g) ��H��+131.3KJ/mol����Ӧ��ƽ�ⳣ������ʽΪK=[C(CO).C(H2)]/C(H2O)���ʴ�Ϊ��[C(CO).C(H2)]/C(H2O)��
CO(g)��H2(g) ��H��+131.3KJ/mol����Ӧ��ƽ�ⳣ������ʽΪK=[C(CO).C(H2)]/C(H2O)���ʴ�Ϊ��[C(CO).C(H2)]/C(H2O)��
��2��A��������Ӱ�췴Ӧ����H ������B���������淴Ӧ��ֵ�㶨����ʾ�����淴Ӧ������ȣ���˵��ƽ���ѽ�������ȷ��C������ƽ���ѹ��ƽ�������ƶ��������ƽ����Է���������![]() =15��18ת��������������ȷ��D������ƽ����¶Ȳ��䣬ƽ�ⳣ�����䣬����ѡBC��
=15��18ת��������������ȷ��D������ƽ����¶Ȳ��䣬ƽ�ⳣ�����䣬����ѡBC��
������3�����ݱ������ݿ�֪��������������ʱ�������¶ȣ�CO2��ת������С����ʾƽ�������ƶ���˵������Ӧ���ȣ�a��0���ʴ�Ϊ������
��4������Ӧ��ijʱ�̲�÷�Ӧ��ϵ�и������Ϊ1mol��Qc=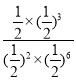 ��1=K��ƽ�������ƶ�����ʱV(CO2)����V(CO2)�����ʴ�Ϊ��<��������Ӧ�ں�ѹ���������н��У����ŷ�Ӧ�Ľ��У���Ӧ���¶����ͣ������¶ȣ�ƽ��������Ӧ�����ƶ���ƽ�ⳣ����������ƽ���CO2�����ʵ������ܴ��ڡ����ڻ�С��1mol����ѡD��
��1=K��ƽ�������ƶ�����ʱV(CO2)����V(CO2)�����ʴ�Ϊ��<��������Ӧ�ں�ѹ���������н��У����ŷ�Ӧ�Ľ��У���Ӧ���¶����ͣ������¶ȣ�ƽ��������Ӧ�����ƶ���ƽ�ⳣ����������ƽ���CO2�����ʵ������ܴ��ڡ����ڻ�С��1mol����ѡD��
������2NH3(g)+CO2(g)=NH2CO2 NH4(s)��H=+l59.5kJ��mol-1����NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) ��H=+116.5kJ��mol-1����H2O(l)=H2O(g)��H=+44.0kJ��mol-1�������Ȼ�ѧ����ʽ��˹���ɼ�����+��+���õ�CO2��NH3�ϳ����غ�Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽΪ��2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) ��H=-87.0KJ/mol���ʴ�Ϊ��2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)��H=-87.0KJ/mol
CO(NH2)2(s)+H2O(g) ��H=+116.5kJ��mol-1����H2O(l)=H2O(g)��H=+44.0kJ��mol-1�������Ȼ�ѧ����ʽ��˹���ɼ�����+��+���õ�CO2��NH3�ϳ����غ�Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽΪ��2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) ��H=-87.0KJ/mol���ʴ�Ϊ��2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)��H=-87.0KJ/mol


 ���ٴ�����ɽ����ϵ�д�
���ٴ�����ɽ����ϵ�д� ���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
���ٴ���������ѧϰ����ѧ�ں����ν�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�õ�������(CuSO4��5H2O)����0.040mol/L��CuSO4��Һ240mL���ش��������⣺
��1����������Ϊ��������ƽ��ҩ�ס��ձ�����Ͳ����ͷ�ιܣ�����Ҫ��Щ��������������ɸ�ʵ�飿��д����__________��
��2����д����ʵ��ļ�Ҫ��ʵ�鲽�裺
����������������_________g��_________��ת����ϴ�Ӳ�ת����������ҡ��
��3����ͼ�Ǹ�ͬѧת����Һ��ʾ��ͼ��ͼ�еĴ�����________��
��4����ͬѧ�ڶ��ݺӸǵ�תҡ�Ⱥ���Һ����ڿ̶��ߣ��ֵμ�����ˮ���̶ȡ���������ҺŨ�ȵ�Ӱ��_________������ƫ��������ƫ����������Ӱ��������
��5������һƿ���ƺõ�CuCl2��Һ����ʱ���������ǩ����Ϊ����������ʢ��CuCl2��Һ����д��ʵ�����������
������� | ʵ����������� |
Cu2+ | |
Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������ȷ����
A��������Ϻ����촵��ƾ���
B������ʱ��©���¶˽����ձ��ڱ�
C�����ձ�����ʱ������Ҫ����ʯ����
D����������ƽ���� NaOH ����ʱ���������� NaOH ���������ֽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͬ�¶Ⱥ�ѹǿ�£�4�������зֱ�װ��4�����壬��֪�������е�������������ݻ��ֱ���a��CO2 100 mL��b��O2200 mL��c��N2 400 mL��d��CH4 600 mL����4������������������ɴ�С��˳����
A. a��b��c��d B. b��a��d��c C. c��d��b��a D. d��c��a��b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽΪC3H6Cl2��ͬ���칹�干��(�����������칹)(����)
A. 3�� B. 4�� C. 5�� D. 6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ�ĸ�Ч���öԱ����������ٽ����ó���������չ������Ҫ���á���β����Ҫ��Ca5(PO4)3F��CaCO3��MgCO3 ��ij�о�С���������β���ۺ����õ��о��������Ʊ�������Ҫ��ҵ��;��CaCO3��Mg(OH)2��P4��H2������������£�
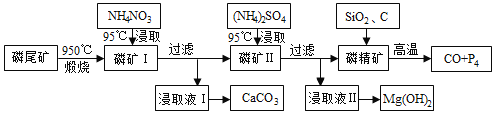
��֪����Ca5(PO4)3F��950�����ֽ⣻
��4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
��1��950��������β�������������Ҫ�ɷ���___________��
��2��ʵ���ҹ�������IJ���������_____________��
��3��NH4NO3��Һ�ܴ���I�н�ȡ��Ca2+��ԭ����__________��
��4���ڽ�ȡҺII��ͨ��NH3��������Ӧ�Ļ�ѧ����ʽ��____________��
��5����ҵ�ϳ�������[Ca5(PO4)3F]�����ᷴӦ�Ʊ����ᡣ��֪25����101kPaʱ��
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ��H=-271kJ/mol
5CaO(s)+H3PO4(l)+HF(g)=Ca5(PO4)3F(s)+5H2O(l) ��H=-937kJ/mol
��Ca5(PO4)3F�����ᷴӦ����������Ȼ�ѧ����ʽ��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������岻��ȱ����Ԫ�أ�Ϊ�˷�ֹ��ȱ�����г�������һ�ּӵ��Σ������ھ���������һ������KIO3��ȥ��ij�о�С��Ϊ�˼��ij�ӵ������Ƿ��е⣬�������йص����ϣ���������ԭ���ǣ�KIO3+5KI+3H2SO4![]() 3I2+3H2O+3K2SO4��
3I2+3H2O+3K2SO4��
��ش��������⣺
��1���÷�Ӧ����������__________��ÿ����1 mol I2ת�Ƶ������ʵ�����__________��
��2����ȡ�����ļӵ��μ�����ˮ�ܽ⣬Ȼ�����ϡ�����KI��Һ��������һ�����ı������۲쵽��������______________________________��
��3��������ƿ��ʹ�÷����У����в�����ȷ����____________������ĸ����
A��������Һʱ����������Һ�壬����Ͳȡ�����ò�����������������ƿ�У�������ˮ���̶���
1~2 cm�����ý�ͷ�ιܼ�����ˮ���̶���
B���Ǻ�ƿ������ʳָ��סƿ������һֻ����סƿ�ף�������ƿ������ת��Σ�ҡ��
C��ʹ������ƿǰ�����Ƿ�©ˮ
D������ƿ��ˮϴ�������ô�����Һϴ��
��4��������ƿ����һ�����ʵ���Ũ�ȵ�ϡ���ᣬ��������������ϡ������ҺŨ��ƫ�ߵ���______������ĸ����
A��ת��ʱû��ϴ���ձ���������
B���ܽ��ʱ����Һû����ȴ�����¾�ת��������
C��ҡ�Ⱥ���Һ����ڿ̶��ߣ��ּ�����ˮ���̶���
D��������ƿ��ˮ����ʱ�۾�����Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA(g)+3B(g) ![]() 2C(g)+2D(g), �����ֲ�ͬ����µķ�Ӧ����, ���з�Ӧ����������
2C(g)+2D(g), �����ֲ�ͬ����µķ�Ӧ����, ���з�Ӧ����������
A��v(D) = 24mol��L-1��min-1
B��v(C) = 0.5mol��L-1��s-1
C��v(B) = 30mol��L-1��min-1
D��v(A) = 0.15 mol��L-1��s-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(CH3)2C(C2H5)CH(CH3)2��������
A. 2��3��3-�������� B. 3��3��4-��������
C. 2��3-����-2-�һ����� D. 2��3-����-3-�һ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com