
【题目】现有前四周期六种元素X、Y、Z、E、F、G,它们的原子序数依次增大,除G外,其他五种元素都是短周期元素。X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分。取F的化合物做焰色反应实验,其焰色呈黄色,G的单质是生活中常见的一种金属,GE是黑色固体。G2E是红色固体。请回答下列问题:
(1)写出基态G原子电子排布式: ;Y、Z、E、F、G的第一电离能由小到大的顺序为 (用元素符号表示)。
(2)X、Y、Z形成3原子分子M,每个原子价层电子均达到稳定结构。M分子的结构式为 。1molM含![]() 键数目为 。
键数目为 。

(3)根据价层电子对互斥理论(VESPR)推测:ZE2—的立体构型为 ,YE32—的中心原子杂化类型为 。
(4)Y、E、Z分别与X形成的简单化合物沸点由高到底的顺序为 (用化学式表示) 。
(5)G晶胞结构如图所示。已知立方体的棱长为apm,G 晶体密度为bg·cm-3,则阿伏加德罗常数NA= (用含a、b的代数式表示)。
【答案】(1)1s22s22p63s23p63d104s1 或[Ar] 3d104s1 Na<Cu<C<O<N
(2) ![]() 2×6.02×1023或2NA(3)V形或角形 sp2 (4)H2O、NH3、CH4
2×6.02×1023或2NA(3)V形或角形 sp2 (4)H2O、NH3、CH4
(5)![]() mol-1
mol-1
【解析】
试题分析:硅太阳能电池X、Y、E三种元素组成的化合物是实验室常用燃料,也是一种家庭常见饮品的主要成分,可知X、Y、E三种元素组成的化合物是乙醇;X、Y、Z、E、F、G,它们的原子序数依次增大,X、Y、E三种元素依次是H、C、O;则Z是N 元素;取F的化合物做焰色反应实验,其焰色呈黄色,则F是Na元素;G是第四周期的元素,G的单质是生活中常见的一种金属,GE是黑色固体。G2E是红色固体,G是Cu元素。(1)写出基态G原子电子排布式:1s22s22p63s23p63d104s1;C、N、O、Na、Cu的第一电离能由小到大的顺序为Na<Cu<C<O<N。
(2)H、C、N形成3原子分子M,每个原子价层电子均达到稳定结构。M分子的结构式为![]() 。1molM含
。1molM含![]() 键数目为2×6.02×1023。
键数目为2×6.02×1023。
(3)根据价层电子对互斥理论(VESPR)推测:NO2—有孤对电子,立体构型为V形;CO32—空间构型为三角形,中心原子C杂化类型为![]() 。
。
(4)水、氨气、甲烷的沸点由高到底的顺序为H2O、NH3、CH4。
(5)Cu晶胞结构如图所示。已知立方体的棱长为apm,体积是![]() ,每个晶胞含有4个原子,一个晶胞的质量是
,每个晶胞含有4个原子,一个晶胞的质量是![]() ,G 晶体密度为bg·cm-3=
,G 晶体密度为bg·cm-3=![]() ,则阿伏加德罗常数NA=
,则阿伏加德罗常数NA=![]() 。
。


科目:高中化学 来源: 题型:
【题目】利用LiOH可制备锂离子电池正极材料。LiOH可由电解法制备,如右图,两极区电解质溶液分别为LiOH和LiCl溶液。下列说法错误的是

A.B极区电解质溶液为LiOH溶液
B.阳极电极反应式为2Cl--2e-=Cl2↑
C.电解过程中主要是H+通过阳离子交换膜向B电极迁移
D.电极A连接电源的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用氟磷灰石[(Ca5(PO4)3F)]生产磷铵[(NH4)3PO4]并制取硫酸、联产水泥。其工艺流程如下图所示:
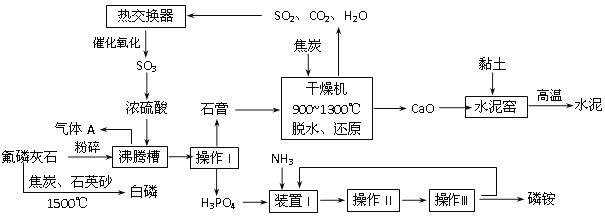
(1)操作I的名称________________;在实验室中操作II包括___________、____________。
(2)沸腾槽的材质是_______________(从“玻璃”、“钢铁”、“附有聚偏氟乙烯防腐层的石墨”中选择),选择的理由是__________________________________________________
(3)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,同时逸出SiF4和CO,反应方程式为:_________________________________________。
(4)黏土中有一种成分为石脂(Al2[OH]4Si2O5·nH2O),其用氧化物表示为____________。
(5)已知SO2的催化氧化反应为2SO2(g)十O2(g) ![]() 2SO3(g) △H<0。
2SO3(g) △H<0。
从化学反应原理的角度说明催化氧化时使用热交换器的原因__________________。
(6)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。拟用下图所示的装置测定硫酸尾气中SO2的含量:

若下列各组中的试剂,前者浓度为0.1mol·L-1,后者适量,溶液体积为5mL;通入尾气10L(已换算为标准状况)时反应管中的溶液恰好变色。判断下列试剂组能否测定硫酸尾气中SO2的体积分数。能者,确定SO2的体积分数;不能者,说明原因。
编号 | 试剂组 | 结论 |
① | NaOH溶液、酚酞试液 | |
② | Na2CO3溶液、酚酞试液 | |
③ | 碘水、淀粉溶液 | |
④ | KMnO4溶液、稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336 mL(标准状况)气体。回答:

(1)直流电源中,M为____________极。
(2)Pt电极上生成的物质是____________,其质量为____________g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为:2∶_______∶________∶_________。
(4)AgNO3溶液的浓度(填“增大”“减小”或“不变”。下同)____________,H2SO4溶液的浓度____________。
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物K在化工和医药方面有重要的应用,其合成路线如下:

已知信息:
①C能发生银镜反应,E的相对分子质量比D大4,G的苯环上的一溴代物有两种
②![]()
![]()
![]()
③2RCH2CHO![]()
![]()
请回答下列问题:
(1)F的名称是__________,H含有的官能团是__________。
(2)A→B的反应类型是__________,F→G的反应类型是__________。
(3)C与银氨溶液反应的化学方程式是__________。
(4)K的结构简式是__________。
(5)符合下列要求的C8H10O的同分异构体有__________种.
①芳香族化合物②与Na反应并产生H2③遇FeCl3溶液呈紫色,
其中核磁共振氢谱为4组峰,且面积比为6:2:1:1的是__________(写出其中一种结构简式)
(6)参照已知信息和成路线,设计一条由CH2=CH2为原料合成CH3CH2CH2CH2OH的路线(注明反应条件):__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长。
(1)已知H3AsO3是两性偏酸性的化合物,H3AsO3中As的化合价为_____,它与足量硫酸反应时生成盐的化学式为_______________。Na2HAsO3溶液呈碱性,原因是_________________(用离子方程式表示),该溶液中c(H2AsO3-) _____c(AsO33-)(填”>”、“<”或“=”)。
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在。
①工业上以雄黄为原料制备砷、鉴定砒霜(As2O3)的原理如下图:

反应a产生的废气直接排放可能带来的环境问题是_______________,请写出反应b的化学方程式:_________________________。
②雌黄可被浓硝酸氧化为H3AsO4与S,硝酸被还原为NO2,反应中还原剂与氧化剂物质的量之比为_________。
③向c(As3+)=0.01mol/L的工业废水中加入FeS固体至砷完恰好完全除去(小于1×10-5mol/L),则此时c(Fe2+)=_____mol/L。(已知Ksp(As2S3)=1×10-22,Ksp(FeS)=6×10-18)
(3)某原电池装置如右图,电池总反应为AsO43-+2I-+H2O![]() AsO33-+I2+2OH-。
AsO33-+I2+2OH-。

当P池中溶液由无色变成蓝色时,正极上的电极反应式为_______________。当电流计指针归中后向Q池中加入一定量的NaOH,则电子由_____(填“P”或“Q”)池流出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物{[Cr(CH3COO)2]22H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂.实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如右图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:

Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)═[Cr(CH3COO)2]22H2O(s)
请回答下列问题:
(1)仪器1的名称是_____________。
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是_____________(选下面的A、B或C);目的是_____________。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液一段时间后再加盐酸
C.先加盐酸一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门_____________(填“A”或“B”,下同),打开阀门_____________。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是_____________。
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]22H2O9.4g,则该实验所得产品的产率为_____________(不考虑溶解的醋酸亚铬水合物)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的_____________,再加入碱液,调节pH至少为_____________才能使铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L).已知Cr(OH)3的溶度积为6.3×10-31,![]() ≈4,lg2≈0.3
≈4,lg2≈0.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”(Funiulele)。有一种有机物的键线式也酷似牛形(下图所示),故称为牛式二烯炔醇。下列有关说法正确的是( )

A.牛式二烯炔醇含有4种官能团
B.牛式二烯炔醇不能使酸性KMnO4溶液褪色
C.1 mol牛式二烯炔醇最多可跟4mol Br2发生加成反应
D.该有机物的化学式为C29H44O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热法炼铬废渣主要成分为Al2O3和Cr2O3,还含有MgO、FeO、Fe2O3等杂质,以下是以炼铬废渣为原料回收Al2O3和Cr2O3的流程图:

已知:
①“焙烧”涉及的主要反应:Na2CO3+Al2O3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
Cr2O3+Na2CO3+O2![]() Na2CrO4+CO2↑(未配平);
Na2CrO4+CO2↑(未配平);
②滤液2中涉及的反应:8CrO42--+3S2O32-+34H+===6SO42-+8Cr3++17H2O
③Ksp[Cr(OH)3]=8×10-32
根据题意回答下列问题:
(1)请完成下列化学方程式的配平:
Cr2O3+ Na2CO3+ O2 ![]() Na2CrO4+ CO2↑;
Na2CrO4+ CO2↑;
(2)炼铬废渣在焙烧前需球磨粉碎,其目的是 。
(3)滤渣1的主要成分是 。
(4)流程中可以循环利用的物质是 。
(5)写出步骤Ⅲ“碳分”的离子反应方程式: 。
(6)滤液2还原后的溶液中为使Cr3+沉淀完全,溶液pH应小于 。(已知:lg5=0.7;当溶液中离子浓度不大于1×10-5mol/L时,可以认为不含该离子)
(7)滤液2经多步操作还可以获得K2Cr2O7晶体,其操作依次是:加入稀硫酸酸化,加入KCl固体、蒸发浓缩、操作a、过滤、操作b、干燥。
①加硫酸酸化的目的是 。
②操作a、操作b分别是 、 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com