
| A. | 漂白粉长期放置会被空气中的氧气氧化而变质 | |
| B. | 医用消毒酒精中乙醇的浓度为95% | |
| C. | 加活性炭吸附水中小颗粒物,净化水质的方法属于物理方法 | |
| D. | 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,“硝”是指硝酸 |
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
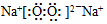 ,该化合物中的化学键类型有离子键、(非极性)共价键.
,该化合物中的化学键类型有离子键、(非极性)共价键.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | CH3OH的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | |||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | Ⅰ中反应在0-40min内的平均速率为v(H2)=0.0020mol•L-1•min-1 | |
| B. | 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 | |
| C. | 三个溶液中反应的平衡常数关系为Ⅱ=Ⅰ>Ⅲ | |
| D. | 若起始时向容器Ⅰ中充入0.020molH2、0.010molCO和0.010molCH3OH,则反应处于平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH的电子式: | B. | 硫离子的结构示意图: | ||
| C. | 次氯酸钠分子式:NaClO | D. | Na2O2中过氧离子的化学式:O22- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
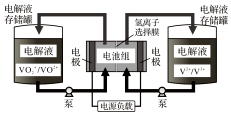 全钒液流电池充电时间短,续航能力强,被誉为“完美电池”.工作原理如图,已知反应的离子方程式:VO2++V3++H2O$?_{放电}^{充电}$VO2++V2++2H+.下列叙述错误的是( )
全钒液流电池充电时间短,续航能力强,被誉为“完美电池”.工作原理如图,已知反应的离子方程式:VO2++V3++H2O$?_{放电}^{充电}$VO2++V2++2H+.下列叙述错误的是( )| A. | 放电时,正极电极反应为:VO2++e-+2H+=VO2++H2O | |
| B. | 充电时,阴极电极反应为:V3++e-=V2+ | |
| C. | 放电时,H+从电池右边移向左边 | |
| D. | 利用该电池电解饱和NaCl溶液(石墨作电极),2 mol VO2+发生氧化反应时,可生成气体44.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 | |
| C. | 0.1molAgCl和0.1molAgl混合后加入1 L水中,所得溶液中c(Cl-)>c(I-) | |
| D. | 25℃时,0.1mol/L的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com