解答:
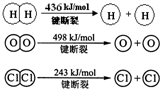
解:Ⅰ、(1)①H
2(g)+Cl
2(g)═2HCl(g)△H=-184kJ/mol
②4HCl(g)+O
2(g)
2Cl
2(g)+2H
2O(g)△H=-115.6kJ/mol
根据盖斯定律①×2+②得:2H
2(g)+O
2(g)=2H
2O(g)△H=-483.6 kJ/mol;
故答案为:2H
2(g)+O
2(g)=2H
2O(g)△H=-483.6 kJ/mol;
(2)2H
2(g)+O
2(g)=2H
2O(g)△H=-483.6 kJ/mol,△H=断裂化学键吸收的能量-形成化学键放出的能量=2×436KJ+498KJ-4×H-O=-483.6 kJ,则得到H-O的键能=463.4kJ;
故答案为:463.4;
Ⅱ(1)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,平衡常数中,分子为生成物,分母为反应物,再结合质量守恒定律,所以该反应的方程式为C(s)+H
2O(g)?CO(g)+H
2(g);
故答案为:C(s)+H
2O(g)?CO(g)+H
2(g);
(2)一段时间后,当N
2、H
2、NH
3的物质的量分别为2mol/L、1mol/L、2mol/L时,Qc=
=0.5,所以该状态是平衡状态,正逆反应速率相等,
欲使得该反应的化学反应速率加快,同时使平衡时NH
3的体积百分数增加,
A.反应是气体体积减小的反应,缩小体积增大压强,反应速率增大,平衡逆向进行,故A正确;
B.反应是放热反应,升高温度,速率增大,平衡逆向进行,故B错误;
C.加催化剂改变反应速率,不改变平衡,故C错误;
D.使氨气液化移走,平衡正向进行,反应速率减小,故D错误;
故答案为:=;A;
(3)①图表分析可知,平衡常数随温度升高增大,说明正反应为吸热反应,△H>0,故答案为:>;
②A(g)+3B(g)?2C(g)+D(s)△H>0,
A.反应速率之比等于化学方程式计量数之比,2v(B)
(正)=3v(C)
(逆),说明C的正逆反应速率相同,反应达到平衡状态,但3v(B)
(正)=2v(C)
(逆)不能说明反应达到平衡状态,故A错误;
B.A和B的转化率相等与起始量、变化量有关,不能说明反应达到平衡状态,故B错误;
C.反应前后气体体积减小,容器内压强保持不变,说明反应达到平衡状态,故C正确;
D.反应前后气体质量减小,体积不变,混合气体的密度保持不变说明反应达到平衡状态,故D正确;
故答案为:CD;
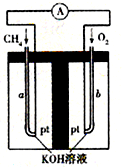
(4)①正极发生还原反应,氧气在正极放电生成氢氧根离子,正极电极反应式为:O
2+4e
-+2H
2O=4OH
-,负极是甲烷失电子在碱溶液中生成碳酸根离子,负极电极反应为:CH
4-8e
-+10OH
-=CO
32-+7H
2O;
故答案为:CH
4-8e
-+10OH
-=CO
32-+7H
2O;
②参与反应的氧气在标准状况下体积为8960mL,物质的量为
=0.4mol,根据电子转移守恒可知,生成二氧化碳为
=0.2mol,n(NaOH)=0.1L×3.0mol?L
-1=0.3mol,n(NaOH):n(CO
2)=0.3mol:0.2mol=3:2,介于1:1与2:1之间,故生成碳酸钾、碳酸氢钾,令碳酸钾、碳酸氢钾的物质的量分别为xmol、ymol,则x+y=0.2,2x+y=0.3,解得x=0.1,y=0.1,溶液中碳酸根水解,碳酸氢根的水解大于电离,溶液呈碱性,故c(OH
-)>c(H
+),碳酸根的水解程度大于碳酸氢根,故c(HCO
3-)>c(CO
32-),钾离子浓度最大,水解程度不大,碳酸根浓度原大于氢氧根离子,故c(K
+)>c(HCO
3-)>c(CO
32-)>c(OH
-)>c(H
+),
故答案为:c(K
+)>c(HCO
3-)>c(CO
32-)>c(OH
-)>c(H
+).



 阅读快车系列答案
阅读快车系列答案
 表示的分子式
表示的分子式