
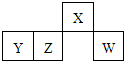
| A、原子半径:W>Z>Y>X |
| B、含Y元素的盐溶液一定显酸性 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X的氢化物能与其最高价氧化物对应的水化物反应生成盐 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素符号 | 元素性质或原子结构 |
| A | A是形成化合物最多的元素 |
| B | B元素的单质在空气中含量最多 |
| C | C元素在地壳中含量最多 |
| D | D元素在同周期中金属性最强 |
| E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
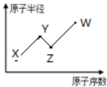 W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ar原子的最外层电子数相差1.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ar原子的最外层电子数相差1.下列说法正确的是( )| A、第一电离能:Z>Y |
| B、Y、W的最简单氢化物的水溶液都呈酸性 |
| C、W单质的水溶液具有漂白性 |
| D、W的单质可从Z的简单氢化物种置换出Z的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①② | B、只有④ |
| C、只有①②③ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A、反应前2min的平均速率v(Z)=0.04 mol/(L?min) |
| B、其他条件不变,升高温度,v(逆)增大,v(正)减小 |
| C、该温度下此反应的平衡常数K=1.44 |
| D、其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com