
| 元素符号 | 元素性质或原子结构 |
| A | A是形成化合物最多的元素 |
| B | B元素的单质在空气中含量最多 |
| C | C元素在地壳中含量最多 |
| D | D元素在同周期中金属性最强 |
| E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
| 32 |
| 2 |


科目:高中化学 来源: 题型:
| 名称 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 6.0 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
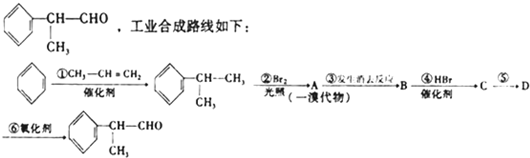
查看答案和解析>>
科目:高中化学 来源: 题型:
| 分类标准 | 能导电的物质 | 电解质 | 非电解质 |
| 属于该类的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
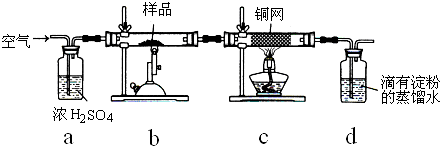
| 1 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
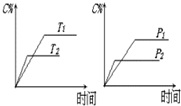 可逆反应a A(s)+b B(g)?c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )
可逆反应a A(s)+b B(g)?c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )| A、达平衡后,加入催化剂则C%增大 |
| B、达平衡后,若升温,平衡左移 |
| C、化学方程式中b<c+d |
| D、达平衡后,增加A的量有利于平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
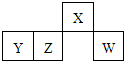
| A、原子半径:W>Z>Y>X |
| B、含Y元素的盐溶液一定显酸性 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X的氢化物能与其最高价氧化物对应的水化物反应生成盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在多电子的基态原子中,不可能有运动状态完全相同的两个电子存在 |
| B、在一个基态多电子的原子中,不可能有两个能量完全相同的电子 |
| C、在多电子的基态原子中,能量最高的电子往往是距离原子核最近的电子 |
| D、对于多电子原子,其核外电子完全按能层次序排布,填满一个能层才开始填下一能层 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com