
| 分类标准 | 能导电的物质 | 电解质 | 非电解质 |
| 属于该类的物质 |
| ②⑦⑧⑨⑩ | ①③⑤⑥⑩ | ④ |


科目:高中化学 来源: 题型:
| ① | A是形成化合物种类最多的元素之一 |
| ② | B元素原子核外各能级所排电子数相同 |
| ③ | D是地壳中含量最多的元素 |
| ④ | E在常温下能与水剧烈反应产生A单质 |
| ⑤ | F是日常生活中最常用的金属之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
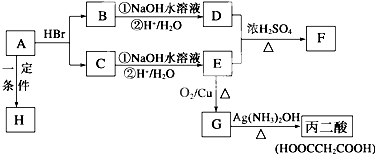
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素符号 | 元素性质或原子结构 |
| A | A是形成化合物最多的元素 |
| B | B元素的单质在空气中含量最多 |
| C | C元素在地壳中含量最多 |
| D | D元素在同周期中金属性最强 |
| E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A、反应前2min的平均速率v(Z)=0.04 mol/(L?min) |
| B、其他条件不变,升高温度,v(逆)增大,v(正)减小 |
| C、该温度下此反应的平衡常数K=1.44 |
| D、其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com