

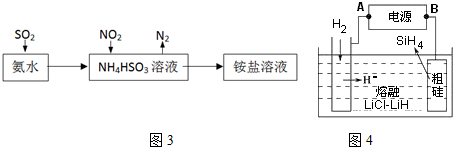
分析 Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后生成Ca(OH)2,发生的一系列离子反应方程式分别为HCO3-+OH-=CO32-+H2O、Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓,加入凝聚剂然后再通入二氧化碳,二级沉降后再通入气体A,A具有强氧化性,能杀菌消毒;
(1)生成的氢氧化钙能和碳酸氢根离子反应生成碳酸根离子,碳酸根离子能和钙离子、镁离子反应生成碳酸钙沉淀、碳酸镁沉淀;
(2)混凝剂能使固体颗粒沉淀,且混凝剂中的硫酸根离子与钙离子结合生成沉淀;
(3)电解质溶液能使氢氧化铁胶体沉淀,酸能使氢氧化铁溶解;
(4)二级沉降后再通入气体A,A具有强氧化性,能杀菌消毒.
解答 解:Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后生成Ca(OH)2,发生的一系列离子反应方程式分别为 HCO3-+OH-=CO32-+H2O、Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓,加入凝聚剂然后再通入二氧化碳,二级沉降后再通入气体A,A具有强氧化性,能杀菌消毒;
(1)生成的氢氧化钙能和碳酸氢根离子反应生成碳酸根离子,碳酸根离子能和钙离子、镁离子反应生成碳酸钙沉淀、碳酸镁沉淀,涉及的离子方程式有HCO3-+OH-=CO32-+H2O、Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓(任写一个),
故答案为:HCO3-+OH-=CO32-+H2O、Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓(任写一个);
(2)混凝剂能使固体颗粒沉淀,且混凝剂中的硫酸根离子与钙离子结合生成沉淀,亚铁离子与碱反应生成沉淀,则既发生物理变化又发生化学变化,故答案为③,故答案为:③;
(3)电解质溶液能使氢氧化铁胶体沉淀,酸能使氢氧化铁溶解,所以稀硫酸溶液能使氢氧化铁胶体沉淀也能溶解氢氧化铁,应该选稀硫酸,故选C;
(4)氯气与水反应生成盐酸和次氯酸,该反应为Cl2+H2O═HCl+HClO,HClO具有强氧化性,能杀菌消毒;作为Cl2的替代品的物质需具有强氧化性,选项中只有②④符合条件,故答案为:②④.
点评 本题考查物质分离提纯,为高频考点,明确元素化合物性质及分离提纯目的是解本题关键,侧重考查学生对基础知识的理解和灵活应用,知道流程图中发生的反应及分离提纯方法,题目难度不大.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
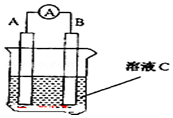 如图原电池装置图:
如图原电池装置图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以淀粉为原料可以制取乙酸乙酯 | |
| B. | 福尔马林可用于浸制标本,是因为其能使蛋白质变性 | |
| C. | 医用酒精通常是指体积分数为75%的乙醇溶液 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
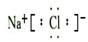 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| B. | CO会与血红蛋白结合,使人中毒;可将中毒病人放入高压氧仓中解毒,其解毒原理符合平衡移动原理 | |
| C. | 2011年5月份起,面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 | |
| D. | 固体煤经处理变为气体燃料后,可以减少SO2和烟尘的排放,且燃烧效率提高,有利于“节能减排” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在氯气中燃烧制氯化钠 | |
| B. | 二氧化锰和浓盐酸共热制氯气 | |
| C. | 氯气与消石灰反应制漂白粉 | |
| D. | 氢气、氯气混合光照后的产生溶于水制盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com