
| A.通入HCl | B.加少量NaOH固体 |
| C.加水 | D.升温 |
科目:高中化学 来源:不详 题型:单选题
| A.硝酸钠固体 |
| B.硝酸钠溶液 |
| C.6mol?L-1硫酸氢钾溶液 |
| D.醋酸钠固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.取等体积的醋酸和盐酸,分别稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m<n |
| B.取等体积的两种酸分别与完全一样的足量锌粒反应,开始时反应速率:盐酸大于醋酸 |
| C.取等体积的两种酸,分别用完全一样的NaOH溶液进行中和,醋酸消耗NaOH的物质的量比盐酸消耗的多 |
| D.两种酸中c(CH3COO-)>c(Cl-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同温下,HF比HClO易电离,则NaF溶液的pH比NaClO溶液的pH大 |
| B.常温下,BaSO4在饱和Na2SO4溶液中的Ksp比在纯水中的Ksp小 |
| C.常温下,0.4mol?L-1 HA溶液和0.2mol?L-1 NaOH溶液等体积混合后的pH等于3,则混合溶液中粒子浓度大小关系:c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-) |
| D.用铂电极电解食盐水,一段时间后两极产生气体体积比为3:2(同条件下),为将电解液恢复原状,则只需向电解液中通入一定量的HCl气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.10mol/L醋酸溶液中粒子浓度的关系满足:c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-) |
| B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
| C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液pH<7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
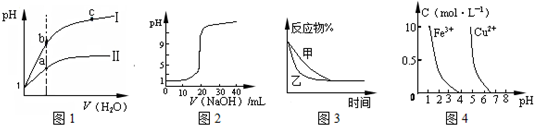
| A.图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 |
| B.图2表示0.1000mol?L-1CH3COOH溶液滴定20.00mL0.1000mol?L-1NaOH溶液所得到的滴定曲线 |
| C.图3表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| D.据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.NaCl的电子式为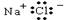 |
| B.NaCl的水溶液是强电解质 |
| C.23Na37Cl中质子数和中子数之比是8:7 |
| D.电解熔融氯化钠可得到氯气和金属钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com