
【题目】在一定条件下1molC3H8发生如下反应:①C3H8→C2H4+CH4②C3H8→C3H6+H2如果C3H8的转化率为80%,且混合气体中m(CH4)=m(H2),则下列说法正确的是( )
A. 反应后混合气体的平均相对分子质量为35.2
B. 两种烯烃物质的量之比,即n(C2H4)/n(C3H6)为1∶1
C. 将混合气体通入溴的四氯化碳溶液,溶液增重128g
D. 两种烯烃物质的量之和,即n(C2H4)+n(C3H6)为0.8mol
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙和X是4种中学化学中常见的物质,其转化关系如下图,则甲和X不可能是
![]()
A. 甲为C,X是O2 B. 甲为CO2,X是NaOH溶液
C. 甲为Cl2,X为Fe D. 甲为Na,X为O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1:3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
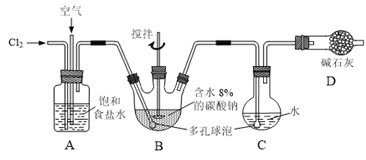
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8℃,42℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是______。
②为使反应充分进行,实验中采取的措施有______。
(2)①写出装置B中产生Cl2O的化学方程式并用单线桥法标出电子转移的方向和数目:______。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是______。
(3)装置C中采用棕色圆底烧瓶是因为______。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用酸式滴定管准确量取20.00 mL次氯酸溶液,______。(可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液。除常用仪器外须使用的仪器有:电子天平,真空干燥箱)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017新课标Ⅱ]丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+![]() O2(g)= C4H8(g)+H2O(g) ΔH2=119 kJ·mol1
O2(g)= C4H8(g)+H2O(g) ΔH2=119 kJ·mol1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=242 kJ·mol1
O2(g)= H2O(g) ΔH3=242 kJ·mol1
反应①的ΔH1为________kJ·mol1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是_________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
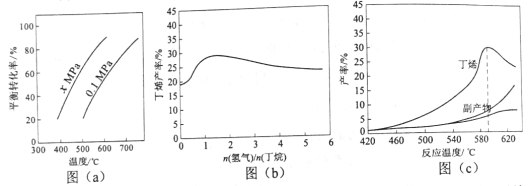
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是__________________________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017新课标Ⅰ节选]近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 K时,将0.10 mol CO2
COS(g) +H2O(g)。在610 K时,将0.10 mol CO2
与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率![]() =_______%,反应平衡常数K=________。
=_______%,反应平衡常数K=________。
②在620 K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率![]() _____
_____![]() ,该反应的
,该反应的![]() H_____0。(填“>”“<”或“=”)
H_____0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列排列顺序正确的是( )
A. 微粒半径:Mg2+>F- B. 稳定性:HI>HBr
C. 熔点:Al>Na D. 酸性:H2SO4>HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠和铝均是重要的金属。
(1) 铝的原子结构示意图是___________________。
(2) 铝与NaOH溶液反应的离子方程式为______________________________;
(3)同温同压下,在体积和浓度均为100 mL 0.2 mol·L-1的盐酸及NaOH溶液中各加入等质量的Al, 产生气体的体积之比为5∶6,则所加Al的质量为______________。
(4) 过氧化钠可做呼吸面具的供氧剂,其中Na2O2与CO2反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置制取NH3,并用AlCl3溶液吸收多余NH3制Al(OH)3,最后回收NH4Cl,能达到实验目的的是

A. 用装置甲制取NH3
B. 用装置乙吸收NH3制取Al(OH)3
C. 用装置丙分离Al(OH)3和NH4Cl溶液时,用玻璃棒不停的在漏斗内搅拌
D. 用装置丁蒸干NH4Cl溶液并灼烧制NH4Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com