
【题目】下列各组离子中,在酸性溶液中能大量共存的无色溶液( )
A.Na+、Cl-、NO3-、SO42-B.K+、Cu2+、NO3-、Cl-
C.Mg2+、Cl-、SO42-、HCO3-D.Ba2+、NO3-、Cl-、CO32-
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】已知相同温度下CH3COOH和NH3H2O的电离常数相等,现向10mL浓度为0.1molL﹣1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.c(NH4+):c(NH3H2O)始终减小
C.c(CH3COOH)与c(CH3COO)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物大分子在生物体的生命活动中具有重要的作用。碳原子本身的化学性质,使它能够通过化学键连接成链或环,从而形成各种生物大分子。可以说,地球上的生命是在碳元素的基础上建立起来的。以上事实可以说明
A. C元素组成所有的的化合物
B. C元素是组成生物体的最基本的元素
C. C元素是各种大分子中含量最多的元素
D. C元素比其他元素重要
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、H、N三种元素在人体的化学成分中,质量分数共占73%左右(占细胞干重的百分比),而在岩石圈的化学成分中,质量分数不到1%,这一事实说明( )
A. 生物界与非生物界具有相似性
B. 生物界与非生物界具有统一性
C. 生物界与非生物界具有差异性
D. 生物界与非生物界的本质完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习与研究化学经常要进行实验,请完成以下课题:
(1)玻璃棒的作用主要有以下三种,请回答下列问题: a.搅拌 b.引流 c.蘸取溶液
①实验室配制一定物质的量浓度溶液,将固体溶解时,玻璃棒的作用是(填字母),
②将烧杯中的溶液注入容量瓶时,玻璃棒的作用是(填字母),
③用浓盐酸检验氨气时,玻璃棒的作用是(填字母),
④粗盐提纯时,用过滤的方法除去不溶性的泥沙,玻璃棒的作用是(填字母).
(2)现用98%的浓H2SO4(ρ)=1.84g/cm3)配制浓度为0.5mol/L的稀硫酸500mL. ①选用的玻璃仪器除了量筒、玻璃棒、烧杯,还用到、 .
②将浓H2SO4沿烧杯内壁慢慢注入盛水的烧杯中,不断搅拌的目的是 , 若搅拌过程中有液体溅出,会使最终结果(填“偏高”、“偏低”或“无影响”).
③定容时必须使溶液凹液面与刻度线相切,若俯视会使结果(填“偏高”、“偏低”或“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料PET聚酯树脂和PMMA的合成路线如下图:
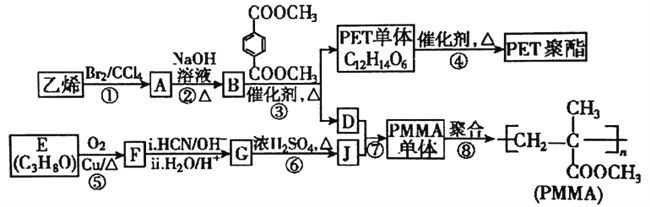
已知:
I.RCOOR+R "OH![]() RCOOR "+ROH (R.R'、R"代表烃基)
RCOOR "+ROH (R.R'、R"代表烃基)
II.  (R代表烃基)。
(R代表烃基)。
(1)PMMA单体的结构简式为_______,PET单体中的官能团名称为________。
(2)反应⑤的反应类型是________;反应②的化学方程式为_________。
(3)若反应④得到的某一条链状产物聚合度为n,则缩聚反应中脱去的小分子有(___)个。
(4)PMMA单体有多种同分异构体,某种异构体K具有如下性质:①不能发生银镜反应②不能使溴水褪色③分子内没有环状结构④核磁共振氢谱有面积比为3:1的两种峰,则K的结构简式为:__________;另一种异构体H含有醛基、羟基和碳碳双键,在铜催化下氧化,官能团种类会减少一种,则H合理的结构共有___种(不考虑立体异构和空间异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。常温时,H2S在水中的电离常数Ka1=1.3×10-7,Ka2=7.0×10-15。按要求回答下列问题:
(1)H2S在水中的二级电离常数表达式Ka2=______;0.1mol/LNa2S溶液中离子浓度由大到小的顺序为__________.
(2)常温下,向0.1mol/LH2S溶液中通入HCl或加入NaOH固体,测得c(S2-)与溶液pH的关系如图(忽略溶液体积的变化及H2S的挥发)。

①当溶液中c(S2-)=1.4×10-19mol/L时,溶液中c(OH-)=______,水电离产生的c(H+)=______.
②当pH=13时,溶液中的c(H2S)+c(HS-)=_______.
(3)在工业废水处理中常用H2S将Mn2+转化为MnS除去。常温下,向含有0.010mol·L-1 Mn2+废水中通入H2S以调节废水的pH,当c(HS-)=2.0×10-4mol·L-1时,Mn2+开始沉淀,此时废水的pH=___。[已知Ksp(MnS)=1.4×10-15]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 化学键的断裂和形成是化学反应中能量变化的主要原因
B. 已知常温下Ksp[Mg(OH)2]=1.8×10-11,则Mg(OH)2在pH=12的NaOH溶液中的溶解度约为1.044×10-6g
C. 水能,风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源
D. 用酚醛树脂制成的塑料可反复加热熔融加工
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.向氨水通入足量SO2:SO2+2NH3H2O═2NH4++SO32﹣+H2O
B.将Ba(OH)2溶液滴入NaHSO4溶液中至SO42﹣恰好完全沉淀:Ba2++SO42﹣+2OH﹣+2H+═BaSO4↓+2H20
C.向醋酸溶液中滴加过量NaOH溶液:H++OH﹣═H2O
D.向新制Cu(OH)2悬浊液中加入乙醛溶液并加热:CH3CHO+2Cu(OH)2+OH﹣ ![]() CH3COO﹣+Cu2O↓+3H2O
CH3COO﹣+Cu2O↓+3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com