
【题目】室温时,将氨水与氯化铵溶液混合得到c(NH3·H2O)+c(NH4+)=0.1mol·L-1的混合溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如图所示。下列说法正确的是
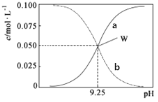
A.W点溶液中:c(H+)=c(OH-)
B.pH=8时溶液中:c(C1-)+c(OH-)=c(H+)+c(NH4+)
C.室温时NH3·H2O的电离平衡常数的值为10-9.25
D.pH=10溶液中:c(NH3·H2O)>c(NH4+)>c(OH-)>c(H+)
【答案】BD
【解析】
随pH增加,铵根的水解和一水合氨的电离均受到抑制,所以c(NH4+)下降,c(NH3H2O)上升,所以a代表一水合氨浓度,b代表铵根浓度。
A.W点溶液pH>7,溶液呈碱性,则c(OH-)>c(H+),故A错误;
B.任何电解质水溶液中都存在电荷守恒,所以pH=8时存在c(Cl-)+c(OH-)= c(H+)+ c(NH4+),故B正确;
C.W点c(NH3H2O)=c(NH4+),室温时NH3H2O的电离平衡常数K=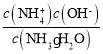 =c(OH-)=10-4.75,故C错误;
=c(OH-)=10-4.75,故C错误;
D.pH=10的溶液呈碱性,则c(OH-)>c (H+),根据图知,c (NH3H2O)>c (NH4+),所以存在c (NH3H2O)>c (NH4+)>c (OH-)>c (H+),故D正确;
故选:BD。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】为了配制![]() 的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入
的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入
①适量的HCl ②适量的NaCl ③适量的氨水 ④适量的NaOH
A.①②B.③C.③④D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)=2HF(g) △H1=-270kJmol-1。下列说法不正确的是( )
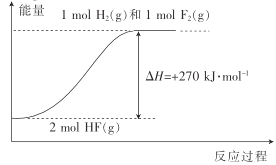
A.1molH2(g)与1molF2(g)的键能之和比2molHF(g)的键能高270kJ·mol-1
B.HF(g)分解为H2(g)与F2(g)的反应过程的能量变化可用如图来表示
C.若反应中有20gHF(g)生成,则放出135kJ热量
D.若H2(g)+Cl2(g)=2HCl(g) △H2=-QkJ·mol-1,则Q<270
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)如图是自来水表的常见安装方式,发生腐蚀过程中,电流从___(填“接头流向水表”或“水表流向接头”)。

(2)某二次电池放电的电池反应为2Fe+O2+2H2O=2Fe(OH)2。反应结束时,电池的负极的质量___(“减小”“不变”或“增加”),该电池的正极反应式为___。
(3)有如图装置:
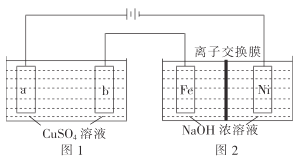
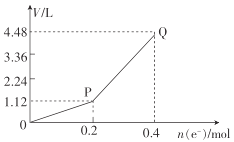
①图1中,用惰性电极电解过程中的实验数据如图,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中图1装置中产生气体的总体积(标准状况)。电解过程中转移n(e-)=0.4mol,b电极的实验现象为___;Q点时,a电极收集到的气体体积为___。
②图2中,装置通电后,溶液仍然保持澄清,铁电极附近呈紫红色(已知FeO42-在水溶液中呈紫红色),Fe电极上发生的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是
A.39g苯蒸气含碳碳双键的数目为1.5NA
B.将1molNH4NO3溶于适量稀氨水中,所得溶液呈中性,则溶液中NH4+的数目为NA
C.高温下,16.8gFe与足量水蒸气完全反应,转移的电子数为0.45NA
D.电解饱和食盐水消耗2molNaCl,加入含2mol HCl的盐酸可恢复到电解前的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NCl3是一种黄色粘稠状液体,常用干杀菌消毒,工业上通过情性电极电解氯化铵和盐酸的方法制备NCl3,其原理如图所示。下列说法正确的是
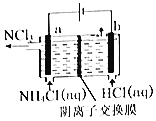
A.在b极区产生的气体是H2
B.a极的电极反应式为NH4+-6e-+ 4OH-+3Cl-=NCl3+4H2O
C.溶液中的Cl-移向a极区
D.若将阴离子交换膜改为阳离子交换膜,NH4Cl的利用率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是一种银白色的金属,常用于金属加工、电镀等。工业以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬及获得强氧化剂Na2Cr2O7。其工艺流程如图所示:

已知:高温氧化时发生反应Fe(CrO2)2+Na2CO3+O2→Na2CrO4+Fe2O3+CO2(未配平)
回答下列问题:
(1)将铬铁矿的主要成分Fe(CrO2)2写成氧化物的形式:__,高温氧化时可以提高反应速率的方法为___(写出一条即可)。
(2)Na2CrO4加入硫酸酸化的离子方程式为__;在实验室中,操作a所用到的玻璃仪器有__。
(3)Na2CrO4中铬元素化合价为__;生成1molNa2CrO4时共转移电子的物质的量为__mol。
(4)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol·L-1以下才能排放,可采用加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入硫酸处理多余的Ba2+的方法处理废水,加入可溶性钡盐后,废水中Ba2+的浓度应大于__mol·L-1,废水处理后达到国家标准才能排放。
查看答案和解析>>
科目:高中化学 来源: 题型:
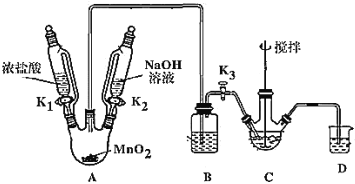
【题目】铋酸钠(NaBiO3)是分析化学中的重要试剂,在水中缓慢分解,遇沸水或酸则迅速分解。某兴趣小组设计实验制取铋酸钠并探究其应用。回答下列问题:
Ⅰ.制取铋酸钠
制取装置如图(加热和夹持仪器已略去),部分物质性质如下:
物质 | NaBiO3 | Bi(OH)3 |
性质 | 不溶于冷水,浅黄色 | 难溶于水;白色 |
(1)装MnO2的仪器名称是_____________,B装置用于除去HCl,盛放的试剂是________________;
(2)C中盛放Bi(OH)3与NaOH混合物,与Cl2反应生成NaBiO3,反应的离子方程式为_____;
(3)当观察到_____(填现象)时,可以初步判断 C 中反应已经完成;
(4)拆除装置前必须先除去烧瓶中残留Cl2以免污染空气,除去Cl2的操作是_______。
(5)反应结束后,为从装置C中获得尽可能多的产品,需要的操作是____________,过滤、洗涤、干燥;
Ⅱ.产品纯度的测定
(6)取上述NaBiO3产品w g,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用 c mo1/L的H2C2O4标准溶液滴定生成的MnO4-(已知:H2C2O4+MnO4---CO2+Mn2++H2O,未配平),当溶液紫红色恰好褪去时,消耗V mL标准溶液。该产品的纯度为 ______________(用含 w、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com