
【题目】铋酸钠(NaBiO3)是分析化学中的重要试剂,在水中缓慢分解,遇沸水或酸则迅速分解。某兴趣小组设计实验制取铋酸钠并探究其应用。回答下列问题:
Ⅰ.制取铋酸钠
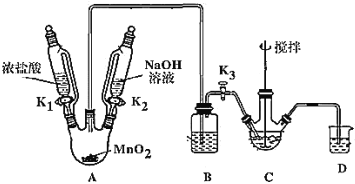
制取装置如图(加热和夹持仪器已略去),部分物质性质如下:
物质 | NaBiO3 | Bi(OH)3 |
性质 | 不溶于冷水,浅黄色 | 难溶于水;白色 |
(1)装MnO2的仪器名称是_____________,B装置用于除去HCl,盛放的试剂是________________;
(2)C中盛放Bi(OH)3与NaOH混合物,与Cl2反应生成NaBiO3,反应的离子方程式为_____;
(3)当观察到_____(填现象)时,可以初步判断 C 中反应已经完成;
(4)拆除装置前必须先除去烧瓶中残留Cl2以免污染空气,除去Cl2的操作是_______。
(5)反应结束后,为从装置C中获得尽可能多的产品,需要的操作是____________,过滤、洗涤、干燥;
Ⅱ.产品纯度的测定
(6)取上述NaBiO3产品w g,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用 c mo1/L的H2C2O4标准溶液滴定生成的MnO4-(已知:H2C2O4+MnO4---CO2+Mn2++H2O,未配平),当溶液紫红色恰好褪去时,消耗V mL标准溶液。该产品的纯度为 ______________(用含 w、c、V的代数式表示)。
【答案】三颈烧瓶 饱和食盐水 Bi(OH)3+3OH-+Na++Cl2=NaBiO3↓+2Cl-+3H2O C中白色固体消失,黄色不再加深 关闭K1、K3,打开K2 在冰水中冷却结晶 ![]() %
%
【解析】
在A中MnO2与浓盐酸反应制取氯气,浓盐酸具有挥发性导致生成的氯气中含有HCl,在装置B中可根据HCl极易溶于饱和食盐水且饱和食盐水能抑制氯气在溶液中的溶解,在C中盛放Bi(OH)3与NaOH混合物,与通入的Cl2反应生成NaBiO3,氯气有毒不能直接排放,但是能和NaOH反应而消除其污染,所以D装置是尾气处理。
(1)根据装置图可知装MnO2的仪器名称是三颈烧瓶,浓盐酸具有挥发性导致生成的氯气中含有HCl,HCl极易溶于水,但是氯气不易溶于饱和氯化钠溶液,所以B装置盛有饱和食盐水以除去杂质HCl;
(2)NaBiO3是为数不多的钠盐沉淀之一,C中盛放的Bi(OH)3与NaOH混合物,与Cl2发生反应产生NaBiO3,根据电子守恒、电荷守恒、原子守恒,可得反应的离子方程式为:Bi(OH)3+3OH-+Na++Cl2=NaBiO3↓+2Cl-+3H2O;
(3)C中原来盛放Bi(OH)3与是白色难溶于水固体,生成物为不溶于冷水的,浅黄色的NaBiO3,所以当观察到C中白色固体消失,黄色不再加深时就可初步判断C中反应已经完成;
(4)氯气有毒不能直接排放,但是能和NaOH反应而消除其污染,所以要让A中NaOH溶液滴下来,吸收氯气,故除去Cl2的操作是关闭K1、K3,打开K2;
(5)想要获得纯净NaBiO3,首先要将让其结晶析出,然后将沉淀过滤出来,再进行洗涤、干燥才可以得到纯净的NaBiO3,由于NaBiO3不易溶于冷水,所以需要的操作有:在冰水中冷却结晶、过滤、洗涤、干燥;
(6)NaBiO3具有强的氧化性,能够将Mn2+氧化为紫红色的MnO4-,反应的离子方程式为:5NaBiO3+2Mn2++14H+=5Bi3++2MnO4-+5Na++7H2O,反应产生的MnO4-会将H2C2O4氧化为CO2气体,反应方程式为5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O,可得关系式5NaBiO3~2MnO4-~5H2C2O4,根据关系式可得1 mol NaBiO3完全反应消耗1 mol H2C2O4,即280 g NaBiO3完全反应消耗1 mol H2C2O4,由于反应消耗草酸的物质的量为n(H2C2O4)=c mol/L×V×10-3 L=cV×10-3 mol,所以NaBiO3的质量为m(NaBiO3)=n·M= cV×10-3 mol×280 g/mol=0.28cV g,所以该产品的纯度为![]() ×100%=
×100%=![]() %。
%。


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】一种可充电锂空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是( )
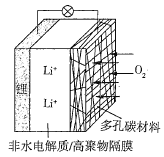
A.放电时,多孔碳材料电极为负极
B.放电时,外电路电子由多孔碳材料电极流向锂电极
C.放电时,电解质溶液中Li+向锂电极迁移
D.放电时,电池总反应为2Li+(1-![]() )O2=Li2O2-x
)O2=Li2O2-x
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,将氨水与氯化铵溶液混合得到c(NH3·H2O)+c(NH4+)=0.1mol·L-1的混合溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如图所示。下列说法正确的是
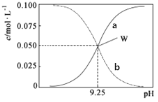
A.W点溶液中:c(H+)=c(OH-)
B.pH=8时溶液中:c(C1-)+c(OH-)=c(H+)+c(NH4+)
C.室温时NH3·H2O的电离平衡常数的值为10-9.25
D.pH=10溶液中:c(NH3·H2O)>c(NH4+)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。回答下列问题:
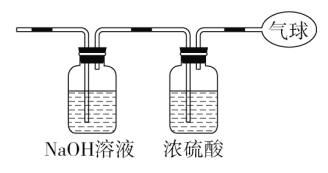
(1)该混合气体的平均摩尔质量:_________________________。
(2)混合气体中碳原子的个数:_________________________
(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过如图装置,最后收集在气球中。
①气球中收集到的气体摩尔质量:_______________________;
②标况下气球中收集到的气体的体积为___________________;
③气球中收集到的气体的电子总数为_____________________
(用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向盛50mL0.100mol·L-1盐酸的两个烧杯中各自匀速滴加50mL的蒸馏水、0.100mol·L-1醋酸铵溶液,测得溶液pH随时间变化如图所示。已知Ka(CH3COOH)=1.8×10-5,Kb(NH3·H2O)=1.8×10-5。下列说法正确的是( )
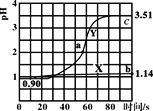
A.曲线X是盐酸滴加蒸馏水的pH变化图,滴加过程中溶液各种离子浓度逐渐减小
B.曲线Y上的任意一点溶液中均存在c(CH3COO-)<c(NH4+)
C.a点溶液中n(Cl-)+n(CH3COO-)+n(OH)-n(NH4+)=0.01mol
D.b点溶液中水电离的c(H+)是c点的102.37倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇酸树脂是一种成膜性好的树脂,如图是一种醇酸树脂的合成线路:

已知:![]()
![]()
![]() 反应①的化学方程式是______.
反应①的化学方程式是______.
![]() 写出B的结构简式是______.
写出B的结构简式是______.
![]() 反应①~③中属于取代反应的是______
反应①~③中属于取代反应的是______![]() 填序号
填序号![]() .
.
![]() 反应④的化学方程式为是______.
反应④的化学方程式为是______.
![]() 反应⑤的化学方程式是______.
反应⑤的化学方程式是______.
![]() 下列说法正确的是______
下列说法正确的是______![]() 填字母
填字母![]() .
.
a B存在顺反异构
b 1molE与足量的银氨溶液反应能生成2mol![]()
c F能与![]() 反应产生
反应产生![]()
d丁烷、![]() 丙醇和D中沸点最高的为丁烷
丙醇和D中沸点最高的为丁烷
![]() 写出符合下列条件的与
写出符合下列条件的与 互为同分异构体的结构简式______.
互为同分异构体的结构简式______.
![]() 能与浓溴水反应生成白色沉淀
能与浓溴水反应生成白色沉淀![]() 苯环上一氯代物有两种
苯环上一氯代物有两种![]() 能发生消去反应.
能发生消去反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置(夹持装置已略) 如图所示。下列说法错误的是

A.①中用胶管连接其作用是平衡气压,便于液体顺利流下
B.实验过程中铜丝会出现红黑交替变化
C.实验开始时需先加热②,再通O2,然后加热③
D.实验结束时需先将④中的导管移出,再停止加热。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物![]() 和
和![]() 的说法正确的是( )
的说法正确的是( )
A.二者的一氯代物均有6种B.二者均能发生取代反应、加成反应和氧化反应
C.二者可用酸性高锰酸钾溶液区分D.![]() 分子中所有碳原子一定在同一平面上
分子中所有碳原子一定在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由丙烯经下列反应可得到F和高分子化合物G,它们都是常用的塑料。
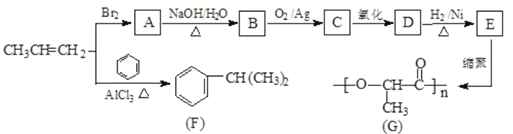
完成下列埴空:
(1)F的分子式为___________,E中含氧官能团的名称是 ___________。
(2)写出反应类型:丙烯直接形成高分子______:A →B __________。
(3)B 转化为 C 的化学方程式为______________________________。
(4)E的一种同分异构体M具有如下性质:
①能发生银镜反应;②l molM与足量的金属钠反应可产生l molH2
则M的结构简式为 ______________________。
(5)写出由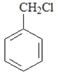 合成
合成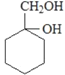 ___________________(合成路线常用表示方法为:X
___________________(合成路线常用表示方法为:X![]() Y......
Y......![]() 目标产物)
目标产物)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com