
����Ŀ�������£���ʢ50mL0.100mol��L-1����������ձ��и������ٵμ�50mL������ˮ��0.100mol��L-1�������Һ�������ҺpH��ʱ��仯��ͼ��ʾ����֪Ka(CH3COOH)=1.8��10-5��Kb(NH3��H2O)=1.8��10-5������˵����ȷ���ǣ� ��
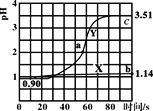
A.����X������μ�����ˮ��pH�仯ͼ���μӹ�������Һ��������Ũ����С
B.����Y�ϵ�����һ����Һ�о�����c(CH3COO-)<c(NH4+)
C.a����Һ��n(Cl-)��n(CH3COO-)��n(OH)-n(NH4+)=0.01mol
D.b����Һ��ˮ�����c(H+)��c���102.37��
���𰸡�B
��������
HCl�м�ˮ���500mL��������101������ʱPH=1+1=2�����ڼ�50mlˮ����Һ���ԶԶС��500mL�����Լ�50mLˮ����ҺPH��2С����X������50mLˮ�ģ�Y�������˴���淋ģ��ݴ˻ش�
A���ɷ�����֪����X�������еμ�ˮ��pH�仯ͼ��HCl��ϡ�ͣ�H+��Cl-Ũ�ȼ�С������Kw=[H+]��[OH-]��֪��[OH-]������A����
B. ������50mL���ᰴʱ������狀�HClǡ����ȫ��Ӧ������Ϊ�����ʵ�����Ũ�Ⱦ�Ϊ0.05mol��L-1��CH3COOH��NH4Cl��CH3COO-Ũ�������ΪKa(CH3COOH)=1.8��10-5������C(CH3COO-)=![]() ����C(NH4+)��0.05mol/L������Y������һ��C(NH4+)> C(CH3COO-)��B��ȷ��
����C(NH4+)��0.05mol/L������Y������һ��C(NH4+)> C(CH3COO-)��B��ȷ��
C. a����Һ�е���غ�Ϊ��n(Cl-)��n(CH3COO-)��n(OH)= n(NH4+)+n(H+)������n(Cl-)��n(CH3COO-)��n(OH)-n(NH4+)= n(H+)��a��pH=2��C(H+)=0.01mol��L-1����Һ�����ԼΪ100ml��n(H+)=0.01mol��L-1��0.1L=0.001mol������n(Cl-)��n(CH3COO-)��n(OH)-n(NH4+)=0.001mol��C����
D. b��λHCl��Һ��ˮ�ĵ����ܵ�HCl�����H+���ƣ�c�㣺һ����CH3COOHΪ���ᣬ��һ���棬NH4+ˮ��ٽ�ˮ�ĵ��룬�ۺ�����b��ˮ�ĵ��������Ƴ̶ȴ���c�㣬D����
��ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ��AgCl(s)![]() Ag��(aq)��Cl��(aq)��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵����ȷ����
Ag��(aq)��Cl��(aq)��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵����ȷ����

A.c���Ӧ��Ksp����a���Ӧ��Ksp
B.����AgNO3������ʹ��Һ��c��䵽d��
C.d��û��AgCl��������
D.��������ˮ��ƽ�����ƣ�Cl��Ũ�ȼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�������ֵ������˵����ȷ����
A.39g��������̼̼˫������ĿΪ1.5NA
B.��1molNH4NO3��������ϡ��ˮ�У�������Һ�����ԣ�����Һ��NH4+����ĿΪNA
C.�����£�16.8gFe������ˮ������ȫ��Ӧ��ת�Ƶĵ�����Ϊ0.45NA
D.��ⱥ��ʳ��ˮ����2molNaCl�����뺬2mol HCl������ɻָ������ǰ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ������ɫ�Ľ����������ڽ����ӹ�����Ƶȡ���ҵ�Ը�����[��Ҫ�ɷ���Fe(CrO2)2]Ϊԭ��ұ���������ǿ������Na2Cr2O7���乤��������ͼ��ʾ��

��֪����������ʱ������ӦFe(CrO2)2��Na2CO3��O2��Na2CrO4��Fe2O3��CO2(δ��ƽ)
�ش��������⣺
��1�������������Ҫ�ɷ�Fe(CrO2)2д�����������ʽ��__����������ʱ������߷�Ӧ���ʵķ���Ϊ___(д��һ������)��
��2��Na2CrO4���������ữ�����ӷ���ʽΪ__����ʵ�����У�����a���õ��IJ���������__��
��3��Na2CrO4�и�Ԫ�ػ��ϼ�Ϊ__������1molNa2CrO4ʱ��ת�Ƶ��ӵ����ʵ���Ϊ__mol��
��4�������йع��ұ�����CrO42-�ķ�ˮҪ����ѧ������ʹ��Ũ�Ƚ���5.0��10-7mol��L-1���²����ŷţ��ɲ��ü�������Ա�������BaCrO4����[Ksp(BaCrO4)=1.2��10-10]���ټ������ᴦ�������Ba2+�ķ���������ˮ����������Ա��κ�ˮ��Ba2+��Ũ��Ӧ����__mol��L-1����ˮ������ﵽ���ұ������ŷš�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����( )
A.��״���£�2.24 L SO3�к�ԭ����Ϊ0.2NA
B.10 mL 12 mol/L Ũ����������MnO2���ȷ�Ӧ���Ƶ������ķ�����0.03NA
C.0.1 mol CH4��0.4 mol Cl2�ڹ����³�ַ�Ӧ������CCl4�ķ�����Ϊ0.1NA
D.���³�ѹ�£�6 g������C-H������ĿΪ0.3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
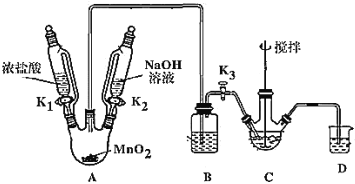
����Ŀ��������(NaBiO3)�Ƿ�����ѧ�е���Ҫ�Լ�����ˮ�л����ֽ⣬����ˮ������Ѹ�ٷֽ⡣ij��ȤС�����ʵ����ȡ�����Ʋ�̽����Ӧ�á��ش��������⣺
����ȡ������
��ȡװ����ͼ(���Ⱥͼг���������ȥ)�����������������£�
���� | NaBiO3 | Bi(OH)3 |
���� | ��������ˮ��dz��ɫ | ������ˮ����ɫ |
(1)װMnO2������������_____________��Bװ�����ڳ�ȥHCl��ʢ�ŵ��Լ���________________��
(2)C��ʢ��Bi(OH)3��NaOH������Cl2��Ӧ����NaBiO3����Ӧ�����ӷ���ʽΪ_____��
(3)���۲쵽_____(������)ʱ�����Գ����ж� C �з�Ӧ�Ѿ���ɣ�
(4)���װ��ǰ�����ȳ�ȥ��ƿ�в���Cl2������Ⱦ��������ȥCl2�IJ�����_______��
(5)��Ӧ������Ϊ��װ��C�л�þ����ܶ�IJ�Ʒ����Ҫ�IJ�����____________�����ˡ�ϴ�ӡ����
��Ʒ���ȵIJⶨ
(6)ȡ����NaBiO3��Ʒw g����������ϡ�����MnSO4ϡ��Һʹ����ȫ��Ӧ������ c mo1/L��H2C2O4����Һ�ζ����ɵ�MnO4-(��֪��H2C2O4+MnO4---CO2+Mn2++H2O��δ��ƽ)������Һ�Ϻ�ɫǡ����ȥʱ������V mL����Һ���ò�Ʒ�Ĵ���Ϊ ______________(�ú� w��c��V�Ĵ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л��������࣬�����������й���ġ������л���������ȷ���ǣ� ��
A.![]() 2������3����Ȳ
2������3����Ȳ
B. 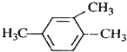 1��3��4�����ױ�
1��3��4�����ױ�
C. CH3��C��CH3��=CH��CH3 3������2����ϩ
D.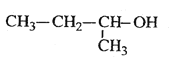 2������
2������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe��Co��Ni��Ϊ�ڢ���Ԫ�أ����ǵĻ��������������������Ź㷺��Ӧ�á�
(1)��̬Niԭ�Ӽ۵����гɶԵ�������δ�ɶԵ�����֮��Ϊ_______.��
(2)��֪FeF3 ���нϸߵ��۵㣨�۵����1000�棩��FeBr3 ��ʽ������FeF3�������۵�ֻ��200�棬ԭ����_____________________________________________________________________��
(3)Co3+��һ��������[Co(N3)(NH3)5]2+��1mol����������������������ĿΪ____����N3-��Ϊ�ȵ������һ�ַ���Ϊ��_______��N3-�����ӻ�����Ϊ________��
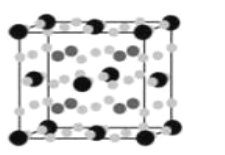
(4)����Fe��Mg��H�γɵĻ�������Ŀǰ�����ѷ��ֵ���������ܶ���ߵĴ������֮һ���侧���ṹ��ͼ��ʾ�����к������Fe�����ɫС�����Mg��dz��ɫС�����H������dz��ɫС��������ϡ��������⣬�ھ����ڲ�����6������д���û�����Ļ�ѧʽ��__________________��

(5)NiO�ľ���ṹ��ͼ��ʾ�����������������AΪ(0��0��0)��BΪ(1��1��0)����C�����������Ϊ_______________��һ���¶��£�NiO��������Է��ط�ɢ���γ��������Ӳ�����������ΪO2-�����õ������У�Ni2+������У���ͼ������֪O2-�İ뾶Ϊapm��ÿƽ��������Ϸ�ɢ�ĸþ��������Ϊ__________g���ú�a��NA�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʵ���Ҫ���Ԫ��֮һ�����ĵ��ʼ��仯�������ʶ�������;�㷺��
(1)��ԭ�Ӻ�������Ų�ʽΪ_________�����������ӹ���_____�ֲ�ͬ����չ����
(2)N2������һ�ּ��������о���ֵ�ķ��ӣ����Ŀռ�ṹ��ͼ����һ����������ṹ(![]() ),��N4��һ��_____________���ӡ�������ԡ��Ǽ��ԡ�)
),��N4��һ��_____________���ӡ�������ԡ��Ǽ��ԡ�)
(3)��ѧ�������о����ô������������ٷɻ�β���е�NO��COת��ΪCO2��N2:2NO+2CO ![]() 2CO2 + N2+Q ( Q��0)���÷�Ӧƽ�ⳣ��K�ı���ʽΪ___________���¶����ߣ�Kֵ________��ѡ��� ������С���������䡱)����������Ӧ���ܱ������з������ﵽƽ��ʱ�����NOת���ʵĴ�ʩ֮һ��_____________________��
2CO2 + N2+Q ( Q��0)���÷�Ӧƽ�ⳣ��K�ı���ʽΪ___________���¶����ߣ�Kֵ________��ѡ��� ������С���������䡱)����������Ӧ���ܱ������з������ﵽƽ��ʱ�����NOת���ʵĴ�ʩ֮һ��_____________________��
(4)���ο��������ʣ�ʵ���Ҽ�������е� NH4+ʱ����ȡ���������Ʒ���Թ��У�����ǿ��Ũ��Һ�����ȣ���������������ʹ___________________��˵����NH4+��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com