
分析 四种钠的化合物,W分解生成碳酸钠、二氧化碳与水,故W为NaHCO3,Z能与二氧化碳、水反应生成氧气,故Z为Na2O2,X为Na2CO3,Y为NaOH,据此解答.
解答 解:(1)根据框图所示的内容,钠的化合物中,受热能分解生成三种产物的是碳酸氢钠,所以W是NaHCO3,Z能与二氧化碳、水反应生成氧气,故Z为Na2O2,X为Na2CO3,Y为NaOH,故答案为:NaHCO3;NaOH;
(2)以上4个化学反应中,反应2Na2O2+2CO2=2Na2CO3+O2↑和2Na2O2+2H20=4NaOH+O2↑中有元素化合价的变化,属于氧化还原反应,故答案为:②③;
(3)碳酸钠和氢氧化钙反应的离子方程式为:CO32-+Ca2+=CaCO3↓,此外该离子反应还可以表示氯化钙和碳酸钾之间的反应,即K2CO3+CaCl2=CaCO3↓+KCl,故答案为:CO32-+Ca2+=CaCO3↓,K2CO3+CaCl2=CaCO3↓+2KCl.
点评 本题为物质推断题,完成此题,关键是根据题干,找出解题的突破口,然后根据物质之间的性质关系,推出其他物质的化学式,并进行解答.


科目:高中化学 来源: 题型:选择题
| A. | 氮氧化合物、PM 2.5颗粒、CO2都会导致酸雨 | |
| B. | 氯水和二氧化硫混合使用能增强漂白效果 | |
| C. | 硫酸铜溶液可用于泳池消毒是利用了Cu2+能使蛋白质盐析 | |
| D. | 轮船上挂锌锭防止铁腐蚀属于牺牲阳极的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅笔芯的原料是铅,儿童用嘴咬铅笔会导致铅中毒 | |
| B. | 在生有煤炉的居室里放一盆水,可以防止CO中毒 | |
| C. | 在农作物温室大棚内燃烧煤,产生的CO2不利于植物的生长 | |
| D. | 高纯硅应用在半导体元件与集成芯片之中,所以说“硅是信息技术革命的催化剂” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溶解、过滤的方法提纯含有少量 BaSO4 的 BaCO3 | |
| B. | 用过滤的方法除去 NaCl 溶液中含有的少量淀粉胶体 | |
| C. | 用渗析的方法精制 Fe(OH)3 胶体 | |
| D. | 用分液的方法分离水和酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).根据图示判断下列说法不正确的是( )
在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.实验中其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).根据图示判断下列说法不正确的是( )| A. | 实验进行时试管 A 中应加入的试剂是普通铁粉 | |
| B. | 烧瓶 B 的作用是防止倒吸,烧瓶 C 的作用是产生水蒸气 | |
| C. | 试管 D 中收集得到的是 H2 | |
| D. | 3 mol 单质 Fe 全部转变为 Fe3O4,失去 8 mol 电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
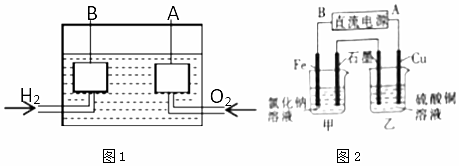
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质都是离子化合物,弱电解质都是共价化合物 | |
| B. | 强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子 | |
| C. | 向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体 | |
| D. | 向Na2CO3饱和溶液中,通入过量的CO2后,加热蒸干得NaHCO3晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol FeCl3能形成的胶体粒子数为0.1NA | |
| B. | 常温下1L pH=12氨水中含有OH-数目为0.01NA | |
| C. | 0.1mol02完全反应时,转移的电子数为0.4NA | |
| D. | 12克碳单质中所含的共价键数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
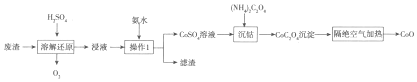
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com