
(8分)将32.64g铜与200mL一定浓度的硝酸反应,铜完全溶解产生的混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为 L,NO2的体积为 L(各保留二位有效数字)。
(2)待产生的气体全部释放后,向溶液加入VmL amol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水 g。
(1)5.8 5.4 (2) (3)57.8
(3)57.8
【解析】(1)硝酸的还原产物一般是NO和NO2,即混合气体是NO和NO2,其物质的量是 。32.64g铜是
。32.64g铜是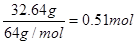 ,共失去电子0.51mol×2=1.02mol。根据得失电子守恒可知n(NO)×3+n(NO2)×1=1.02mol,又因为n(NO)+n(NO2)=0.5mol,所以n(NO)=0.26mol,n(NO2)=0.24mol,其体积分别是0.26mol×22.4L/mol=5.8L,11.2L-5.8L=5.4L。
,共失去电子0.51mol×2=1.02mol。根据得失电子守恒可知n(NO)×3+n(NO2)×1=1.02mol,又因为n(NO)+n(NO2)=0.5mol,所以n(NO)=0.26mol,n(NO2)=0.24mol,其体积分别是0.26mol×22.4L/mol=5.8L,11.2L-5.8L=5.4L。
(2)溶液中的Cu2+恰好全部转化成沉淀后,留在溶液中的就只有硝酸钠,根据钠原子守恒可知硝酸钠是0.001Vamol,再根据氮原子守恒可知,原硝酸的物质的量是(0.001Vamol+0.5mol),所以原硝酸溶液的浓度为 。
。
(3)若使NO和NO2气体全部转化为硝酸钠,则相当于硝酸从铜中得到的电子又被双氧水得到。因为双氧水的还原产物是水,即1molH2O2在反应中得到2mol电子,所以根据得失电子守恒可知需要双氧水的物质的量是 ,其质量为0.51mol×34g/mol=17.34g,因此需要30%的双氧水的质量是17.34g÷30%=57.8g。
,其质量为0.51mol×34g/mol=17.34g,因此需要30%的双氧水的质量是17.34g÷30%=57.8g。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| aV×10-3+0.5 |
| 0.14 |
| aV×10-3+0.5 |
| 0.14 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
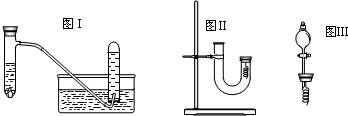
| 实验步骤 | 问题 |
| 1从U型管左端加入稀硝酸直至充满U型管右端 | ∥/ |
| 2用附有铜丝的胶塞塞住U型管右端,观察现象 | 现象是 有无色气体产生,右边溶液逐渐变成绿色 有无色气体产生,右边溶液逐渐变成绿色 |
| 3待反应停止后打开胶塞,观察实验现象 | 现象是 无色气体与空气接触后立即变成红棕色 无色气体与空气接触后立即变成红棕色 |
| 10-3a﹒V +0.5 |
| 0.14 |
| 10-3a﹒V +0.5 |
| 0.14 |
| 1 |
| 2 |
|
|
| 1 |
| 2 |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com