
【题目】如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
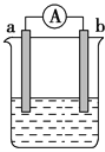
(1)若电极a为Zn,电极b为石墨,当电解质溶液为稀硫酸时,该电池的负极的电极反应式为:___;当反应中收集到标准状况下672 mL气体时,电池中所转移的电子数目为____。
(2)现设计一燃料电池,以电极a为正极,电极b为负极,甲醇(CH4O)为燃料,采用氢氧化钠溶液为电解质溶液,则氧气应通入____极(填“a”或“b”),另一电极的电极反应式____。
【答案】Zn-2e-=Zn2+ 0.06NA a CH4O-6e-+8OH-=CO32-+6H2O
【解析】
(1)活动性强的电极为负极,失去电子发生氧化反应,活动性弱的电极为正极,正极上溶液中氢离子得到电子变为氢气,每反应产生1 mol H2,得到2 mol电子,由氢气的体积计算其物质的量,然后计算转移的电子数目;
(2)通入燃料甲醇的电极为负极,负极上甲醇被氧化产生的CO2与溶液中OH-结合形成CO32-,通入氧气的电极为正极,正极上氧气得到电子,发生还原反应。
(1)由于电极活动性:Zn>C,所以Zn为负极,失去电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+;石墨电极为正极,正极上H+得到电子变为H2,电极反应式为:2H++2e-= H2↑,可见每反应产生1 mol H2,得到2 mol电子,n(H2)=![]() =0.03 mol,所以转移电子的物质的量是0.06 mol,则转移电子数目为N(e-)=0.06 mol×NA/mol=0.06NA。
=0.03 mol,所以转移电子的物质的量是0.06 mol,则转移电子数目为N(e-)=0.06 mol×NA/mol=0.06NA。
(2)通入燃料甲醇的电极为负极,通入氧气的电极为正极。由于该燃料电池以电极a为正极,电极b为负极,是a电极通入氧气,b电极通入甲醇。b电极为负极,负极上甲醇被氧化产生的CO2与溶液中OH-结合形成CO32-,所以负极的电极反应式为:CH4O-6e-+8OH-=CO32-+6H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)===2H2O(1) ΔH=-572 kJ·mol-1。请回答下列问题:
(1)生成物能量总和________(填“大于”“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气燃烧生成水蒸气,则放出的热量________(填“大于”“小于”或“等于”)572 kJ。
(3)H2的标准燃烧热ΔH=________。
(4)反应2H2+O2![]() 2H2O的能量变化如图所示。已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。则反应过程(Ⅱ)________(填“吸收”或“放出”)________kJ。
2H2O的能量变化如图所示。已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。则反应过程(Ⅱ)________(填“吸收”或“放出”)________kJ。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.室温下浓度均为0.1 mol/L的盐酸和氨水混合呈中性时,消耗盐酸的体积大于氨水
B.室温下向0.1 mol/L氨水中加入等浓度等体积的盐酸,溶液导电能力增强
C.室温下pH相等的CH3COOH溶液和盐酸中,c(OH-)相等
D.室温下pH=1的CH3COOH溶液和pH=13的NaOH溶液中,c(CH3COO-)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从巴旦杏中提取有香味的有机物R,结构简式如图所示。下列有关R的说法错误的是
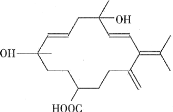
A.R既能与碳酸氢钠溶液反应,又能与钠粒反应
B.R能发生酯化、加成、氧化反应
C.R的羟基能在铜、加热条件下与O2反应生成醛基
D.R的分子式为C21H32O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒氧化还原液流电池是一种新型绿色的二次电池。其工作原理如图所示。下列叙述正确的是

A.电子由Y极流出,经质子交换膜到X极
B.放电过程中,电解质溶液pH降低
C.Y极反应式为V2+-e-=V3+
D.每转移1 mol,电子理论上有2 mol H+由交换膜右侧向左侧迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)=C(g) △H,分两步进行:
①A(g)+B(g)=X(g) △H1 ②X(g)=C(g) △H2
反应过程中能量变化如图所示,E1表示A+B=X的活化能,下列说法正确的是( )
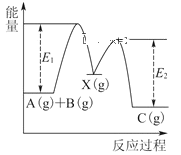
A.△H=E1-E2
B.X是反应A(g)+B(g)=C(g)的催化剂
C.E2是反应②的活化能
D.△Hl=△H-△H2>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d、e的原子序数依次增大。a的简单阴离子与锂离子具有相同的电子层结构,b原子最外层电子数等于内层电子数的2倍。d的单质与稀盐酸剧烈反应放出a2。在1L0.2mol·L-1a2e的水溶液中缓慢通入ec2气体,该溶液的pH与ec2气体体积(标准状况)的关系如图所示。下列说法不正确的是
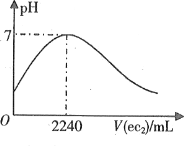
A.a和b可构成所有原子共平面的分子
B.在b、c、e的气态氢化物中,c的最稳定
C.d的氯化物一定能破坏水的电离平衡
D.e的最高价含氧酸与其氢化物可能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Co原子的价电子排布式为_______,Co2+核外3d能级上有_____对成对电子。
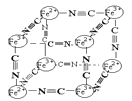
(2)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是________。1 mol配离子中所含σ键的数目为________,配位体N3-中心原子的杂化类型为________。
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+,其原因是_________________________________________________。
(4)某蓝色晶体晶体结构如图,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的体心上。据此可知该晶体的化学式为________,立方体中Fe2+间连接起来形成的空间构型是________。K+空缺率(体心中没有K+的占总体心的百分比)为_____________。
(5)NiO的晶胞结构如图甲所示,其中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为________。
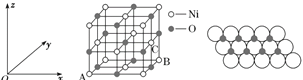
图甲 图乙
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为________g(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按第26届国际计量大会重新定义,阿伏加德罗常数(NA)有了准确值6.02214076×1023。下列说法正确的是( )
A.12gNaHSO4在熔融状态下可以电离出的阳离子数目0.1NA
B.用23.5gAgI与水制成的胶体中胶体粒子数目为0.1NA
C.标准状况下,2.24LCl2全部溶于水所得溶液中的Cl-与ClO-数目之和为0.2NA
D.1.0L18.4mol/LH2SO4溶液与足量铜在加热的条件下反应,被还原的H2SO4分子数目为9.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com