
【题目】含硫各微粒![]() 、
、![]() 和
和![]() 存在于
存在于![]() 与NaOH溶液反应后的溶液中,它们的物质的量分数
与NaOH溶液反应后的溶液中,它们的物质的量分数![]() 与溶液pH的关系如下图所示.下列说法正确的是
与溶液pH的关系如下图所示.下列说法正确的是

A.![]() 时,溶液中
时,溶液中![]()
B.![]() 时,溶液中
时,溶液中![]()
C.为获得尽可能纯的![]() ,可将溶液的pH控制在
,可将溶液的pH控制在![]() 左右
左右
D.由图中数据可估算出![]() 为
为![]()
【答案】C
【解析】
A.当溶液的pH=8时,根据图示得到溶液是亚硫酸钠和亚硫酸氢钠的混合物,离子浓度大小顺序是:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+),则c(SO32-)>c(HSO3-),故A错误;
B.pH=7时,溶液呈中性,c(H+)=c(OH-),溶液中存在电荷守恒:c(H+)+c(Na+)=c(HSO3-)+2c(SO32-)+c(OH-),故溶液中c(Na+)=c(HSO3-)+2c(SO32-),故B错误;
C.图象可知,为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右,故C正确;
D.由图中数据,pH=2时,c(HSO3- )=c(H2SO3 ),HSO3-SO32-+H+,则由Ka的表达式可知,H2SO3的第二级电离平衡常数K2=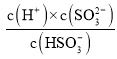 =
=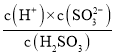 ≈c(H+)=10-2,故D错误;
≈c(H+)=10-2,故D错误;
故答案为C。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.用冷却结晶法来提纯含有少量氯化钾杂质的硝酸钾晶体
B.检验溶液中存在![]() 的常用方法是:往溶液中加入KSCN溶液,溶液不变色;再滴入新制氯水,溶液变成血红色
的常用方法是:往溶液中加入KSCN溶液,溶液不变色;再滴入新制氯水,溶液变成血红色
C.将石油裂化产物通入溴水中,可观察到液体分层且上下两层均为无色
D.进行淀粉水解实验时,为检验水解产物和水解是否完全,加液顺序通常如下:淀粉溶液![]() 溶液
溶液![]() 溶液
溶液![]() 碘水
碘水![]() 新制
新制![]() 悬浊液
悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】因在航空、核能、电池等高技术领域的重要作用——锂被称为“21世纪的能源金属”。完成下列填空:
(1)锂位于元素周期表的________。锂的很多化学性质与镁相似,请依据元素周期律进行解释:_________。
(2)氢化锂(LiH)是离子化合物,写出其阴离子的电子式_______________,LiH中阴离子半径大于阳离子半径,其原因是__________________________________________________。
(3) 工业上用Li2CO3制取锂的化合物及金属锂。碳原子核外电子有________种不同能量的电子,其中有两个电子的能量最高且能量相等,这两个电子所处的轨道是_____________________。
(4)用Li2CO3、氨水和液溴制备LiBr·H2O的流程如下:

①合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:
Li2CO3+Br2+ NH3·H2O→LiBr+(___) __________。
②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到LiBr·H2O晶体的实验步骤:_____、过滤、用乙醇洗涤,干燥。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中 A、B、C、D 分别是三种烃的分子结构,请回答下列问题:

(1)上图中D是有机物分子的_____模型(填“球棍”或者“比例”)。
(2)烃A及其同系物的分子式符合通式_____(碳原子个数用 n 表示)。
(3)下列关于烃C的叙述正确的是_____(填序号)。
a.分子式为 C6H6,它不能使酸性 KMnO4 溶液褪色,属于饱和烃
b.从分子结构看,C分子中含有碳碳双键,属于烯烃
c.烃C中加入溴水,充分振荡,静置,下层无色
(4)写出 B 使溴水褪色的化学方程式___,该反应类型:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用元素周期律分析下面的推断,其中错误的是![]()
A.铍![]() 的氧化物对应的水化物可能具有两性
的氧化物对应的水化物可能具有两性
B.砹![]() 为有色固体,HAt不稳定,AgAt感光性很强,且不溶于水也不溶于酸
为有色固体,HAt不稳定,AgAt感光性很强,且不溶于水也不溶于酸
C.硒化氢![]() 是无色、有毒且稳定性比硫化氢还差的气体
是无色、有毒且稳定性比硫化氢还差的气体
D.同一主族的元素从上到下,金属性呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献。
(1)某兴趣小组为研究原电池原理,设计如图装置。

①a和b不连接时,烧杯中发生反应的离子方程式是 ________________________________________。
②a和b用导线连接,Cu极为原电池________极(填“正”或“负”),该电极反应式是_____________________________,溶液中的H+移向________(填“Cu”或“Zn”)极。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.2 mol电子, 则理论上Zn片质量减轻________g。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为: _________________________。
②电池工作一段时间后电解质溶液的pH__________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,配制一组c(H2A)+c(HA-)+c(A2-)=0.10mol·L-1的H2A和NaOH的混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法中正确的是( )
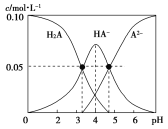
A.在c(Na+)=0.10mol·L-1的溶液中:c(A2-)-c(H+)=c(H2A)-c(OH-)
B.pH=4的溶液中:c(HA-)=c(H2A)+c(A2-)
C.pH=7的溶液中:c(Na+)=c(A2-)+c(HA-)
D.Ka1(H2A)的数量级为10-5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,回答下列小题。
铁放置时间长了就会生锈。铁容易生锈,除了由于它的化学性质活泼以外,同时与外界条件也有很大关系。水分是使铁容易生锈的物质之一。然而,光有水也不会使铁生锈,只有当空气中的氧气溶解在水里时,氧在有水的环境中与铁反应,才会生成一种叫氧化铁的东西,这就是铁锈,铁生锈总的反应为4Fe+3O2+xH2O![]() 2Fe2O3·xH2O。铁锈是一种棕红色的物质,它不像铁那么坚硬,很容易脱落,一块铁完全生锈后,体积可胀大8倍。如果铁锈不除去,这海绵状的铁锈特别容易吸收水分,铁也就锈蚀的更快了。
2Fe2O3·xH2O。铁锈是一种棕红色的物质,它不像铁那么坚硬,很容易脱落,一块铁完全生锈后,体积可胀大8倍。如果铁锈不除去,这海绵状的铁锈特别容易吸收水分,铁也就锈蚀的更快了。
【1】铁生锈总反应属于 ( )
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
【2】关于反应4Fe(OH)2+O2+2H2O![]() 4Fe(OH)3,下列说法正确的是 ( )
4Fe(OH)3,下列说法正确的是 ( )
A.O2发生还原反应
B.Fe(OH)2被还原
C.H2O发生氧化反应
D.H2O是氧化剂
【3】下列反应条件的改变对4Fe+3O2+xH2O![]() 2Fe2O3·xH2O速率的影响不正确的是( )
2Fe2O3·xH2O速率的影响不正确的是( )
A.增大O2的浓度能加快生锈速率
B.潮湿环境中铁生锈的速率更快
C.升高温度能加快生锈速率
D.干燥空气中铁生锈速率更快
【4】下列反应吸收热量的是 ( )
A.铁与稀盐酸反应
B.铁丝在氧气中燃烧
C.铝还原氧化铁
D.碳与二氧化碳反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是![]()
A.金刚石、SiC、NaF、NaCl、![]() 、
、![]() 晶体的熔点依次降低
晶体的熔点依次降低
B.CaO晶体结构与NaCl晶体结构相似,CaO晶体中![]() 的配位数为6,且这些最邻近的
的配位数为6,且这些最邻近的![]() 围成正八面体
围成正八面体
C.设NaCl的摩尔质量为![]() ,NaCl的密度为
,NaCl的密度为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]()
![]() ,在NaCl晶体中,两个距离最近的
,在NaCl晶体中,两个距离最近的![]() 中心间的距离为
中心间的距离为
D.X、Y可形成立方晶体结构的化合物,其晶胞中X占据所有棱的中心,Y位于顶角位置,则该晶体的化学式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com