
����Ŀ������ʱ������һ��c(H2A)��c(HA��)��c(A2��)��0.10mol��L��1��H2A��NaOH�Ļ����Һ����Һ�в����������ʵ���Ũ����pH�ı仯������ͼ��ʾ������˵������ȷ���ǣ� ��
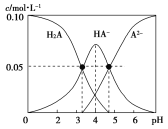
A.��c(Na��)��0.10mol��L��1����Һ�У�c(A2��)��c(H��)��c(H2A)��c(OH��)
B.pH��4����Һ�У�c(HA��)��c(H2A)��c(A2��)
C.pH��7����Һ�У�c(Na��)��c(A2��)��c(HA��)
D.Ka1(H2A)��������Ϊ10��5
���𰸡�A
��������
A. ���������غ㣬 c(Na��)��0.10mol��L��1����Һ��������Na HA�����������غ�c(A2��)��c(H��)��c(H2A)��c(OH��)����A��ȷ��
B. c(H2A)��c(HA��)��c(A2��)��0.10mol��L��1������ͼʾ��pH��4����Һ�У�c(HA��)����0.05mol��L��1������c(H2A)��c(A2��)С��0.05 mol��L��1����B����
C. ���ݵ���غ�c(Na��)+ c(H��)��2c(A2��)��c(HA��)+ c(OH��)������pH��7����Һ��c(Na��)��2c(A2��)��c(HA��)����C����
D.����ͼ��c(H2A)=c(HA��)ʱ��pH=3.3�� Ka1(H2A)=10-3.3��������Ϊ10��4����D����
�ʴ�ѡA��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO��H2�ڹ�ҵ�ϳ���Ϊ��Ҫ�Ļ���ԭ�ϣ���������Ϊ�ϳ�������ҵ��CH4��H2O ��������Ŀǰ���ģ��ȡ�ϳ�������Ҫ��������ԭ��Ϊ��
��Ӧ��CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1 = +210kJ/mol
CO(g)+3H2(g) H1 = +210kJ/mol
��Ӧ��CO(g)+ H2O(g)![]() CO2(g)+H2(g) H2 =��41kJ/mol
CO2(g)+H2(g) H2 =��41kJ/mol
��1��CH4(g)��H2O(g)��Ӧ���� CO2(g)��H2(g)���Ȼ�ѧ����ʽ�� ___________________________��
��2����Ӧ��ﵽƽ��ı�־����____________��
a.���º�������£�ѹǿ���ٸı� b. v(CO):v(H2)=1:3
c.ƽ����Է����������ٸı� d.���º�������£������ܶȲ��ٸı�
��3���������ݻ����䣬�����Ƿ�Ӧ�Է�Ӧ�����д�ʩ������ CO ת���ʵ�����____________��
a�������¶� b���� CO2 ����ϵ���� c������ He��ʹ��ϵ��ѹǿ���� d����ԭͶ�ϱȼӱ�Ͷ��
��4��ij�¶��£����ڷ�Ӧ�� n(H2O)��n(CH4) = 1��1 ��ԭ������������ܱ������У���ʼѹǿΪ P0����Ӧ�� ƽ��ʱ��ѹǿΪ P1����ƽ��ʱ�����ת����Ϊ ____________________________ (���Ը���Ӧ)��
��5���� 1molCH4(g) �� 1molH2O(g)������º�ѹ���ܱ�������(�¶� 298K��ѹǿ 100kPa)��������Ӧ������ ��Ӧ��ķ������÷�Ӧ�У�����Ӧ���� v ��=k ����p(CH4)��p(H2O) , �淴Ӧ���� v ��=k ����p(CO)��p3(H2)������ k ����k �� Ϊ���ʳ�����p Ϊ��ѹ(��ѹ=��ѹ�����ʵ�������)����÷�Ӧ��ѹǿƽ�ⳣ�� Kp= ____________________________ (�� k ����k ����ʾ)���� �������� k ��=4.4��104kPa-1��s-1,�� CH4 �ֽ� 20%ʱ��v ��= ___________________________kPa��s-1��������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��е�ʵ������ܴﵽʵ��Ŀ�Ļ��ܵó���Ӧ���۵���![]()
ѡ�� | ʵ����� | ʵ��Ŀ�Ļ���� |
A | ��һ��Ũ�ȵ� |
|
B | ȡ���� | ���� |
C | ��ij��Һ�еμ� | ˵��ԭ��Һ��һ������ |
D | ������ | ��ȥ |
A.A
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������![]() ��
��![]() ��
��![]() ������
������![]() ��NaOH��Һ��Ӧ�����Һ�У����ǵ����ʵ�������
��NaOH��Һ��Ӧ�����Һ�У����ǵ����ʵ�������![]() ����ҺpH�Ĺ�ϵ����ͼ��ʾ������˵����ȷ����
����ҺpH�Ĺ�ϵ����ͼ��ʾ������˵����ȷ����

A.![]() ʱ����Һ��
ʱ����Һ��![]()
B.![]() ʱ����Һ��
ʱ����Һ��![]()
C.Ϊ��þ����ܴ���![]() ���ɽ���Һ��pH������
���ɽ���Һ��pH������![]() ����
����
D.��ͼ�����ݿɹ����![]() Ϊ
Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��������֮���ת����ϵ��ͼ��ʾ![]() ���ֲ�������ȥ
���ֲ�������ȥ![]() ������˵����ȷ����
������˵����ȷ����![]()

A.��AΪ![]() ��Һ��B����Ϊ��ˮ����Ӧ
��Һ��B����Ϊ��ˮ����Ӧ![]() �����ӷ���ʽΪ��
�����ӷ���ʽΪ��![]()
B.��AΪFe��B����Ϊϡ���ᣬ��Ӧ![]() �����ӷ���ʽΪ��
�����ӷ���ʽΪ�� ![]()
C.��AΪNaOH��Һ��B����Ϊ![]() ������
������![]() ��Һ����C��D��Һ
��Һ����C��D��Һ
D.��AΪ![]() ��B����Ϊ
��B����Ϊ![]() ��ʵ���ҿ��ü��ȹ���C�ķ�����ȡ
��ʵ���ҿ��ü��ȹ���C�ķ�����ȡ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£������й�������ȷ����
A. 0.1 mol��L1 Na2S��Һ��0.1 mol��L1 NaHS��Һ����������3c(Na+)2c(HS)=2c(S2)+2c(H2S)
B. ��20 mL 0.1 mol��L1 NH4HSO4��Һ�е���0.1 mol��L1 NaOH��Һ 20 mL��2c(![]() )=c(NH3��H2O)+c(
)=c(NH3��H2O)+c(![]() )
)
C. 10 mL 0.1 mol��L1 CH3COONa��Һ��6 mL 0.2 mol��L1�����ϣ�c(Cl)>c(Na+)>c(OH)>c(H+)
D. 0.2 mol��L1 NaHCO3��Һ��0.1 mol��L1 NaOH��Һ�������ϣ�3c(![]() )+6c(H2CO3)c(Na+)=3c(OH)3c(H+)
)+6c(H2CO3)c(Na+)=3c(OH)3c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ԫ���ᣬ�������������볣���ֱ��ǣ�Ka1��7.1��10��3��Ka2��6.2��10��8��Ka3��4.5��10��13������������⣺
��1��������ͬŨ�Ȣ�Na3PO4����Na2HPO4����NaH2PO4��pH��С�����˳��___(�����)��
��2�������£�NaH2PO4��ˮ��ҺpH___(����>����<����������)7��
��3�������£�Na2HPO4��ˮ��Һ��___(����������������������)�ԣ���Ka��Kh����Դ�С��˵���ж����ɣ�__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��һ���ۺϴ���SO2�����Ĺ������̣���ÿ������ȫ��Ӧ������˵����ȷ���� ( )

A.��ҺB�з����ķ�ӦΪ2SO2��O2=2SO3
B.�������Ը��������Һ������ҺC���Ƿ���Fe3��
C.���������̿���֪�����ԣ�Fe3��>O2>SO42��
D.�˹��յ��ŵ�֮һ��������ѭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.���ˡ��ᾧ�����ա���ȡ����Һ������ȶ��dz��õķ����л������ķ���
B.���к��ȵIJⶨʵ���У�������������ҺѸ�ٵ���ʢ����������ȼ��У�������������¼��Һ����ʼ�¶ȣ���ַ�Ӧ���ٶ�������¼��Ӧ��ϵ������¶�
C.ʵ��������֪Ũ�ȵĴ�����Һ�ζ�δ֪Ũ�ȵ�����������Һʱ��ѡ�÷�̪��ָʾ�����ü�����ָʾ��ʱ���������ҪСһЩ
D.��Һ���ơ��к͵ζ�ʵ���У�����ƿ����ƿ������ˮϴ����ʹ�ã����ζ��ܡ���Һ��������ˮϴ���������ô�ʢҺ��ϴ2��3�κ�ʹ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com