
【题目】CO和H2在工业上常作为重要的化工原料,其混合气称为合成气。工业上CH4—H2O 催化重整是目前大规模制取合成气的重要方法,其原理为:
反应Ⅰ:CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1 = +210kJ/mol
CO(g)+3H2(g) H1 = +210kJ/mol
反应Ⅱ:CO(g)+ H2O(g)![]() CO2(g)+H2(g) H2 =﹣41kJ/mol
CO2(g)+H2(g) H2 =﹣41kJ/mol
(1)CH4(g)、H2O(g)反应生成 CO2(g)、H2(g)的热化学方程式是 ___________________________。
(2)反应Ⅰ达到平衡的标志是(____________)
a.恒温恒容情况下,压强不再改变 b. v(CO):v(H2)=1:3
c.平均相对分子质量不再改变 d.恒温恒容情况下,气体密度不再改变
(3)若容器容积不变,不考虑反应Ⅰ,对反应Ⅱ下列措施可增加 CO 转化率的是(____________)
a.升高温度 b.将 CO2 从体系分离 c.充入 He,使体系总压强增大 d.按原投料比加倍投料
(4)某温度下,对于反应Ⅰ,将 n(H2O)∶n(CH4) = 1∶1 的原料气充入恒容密闭容器中,初始压强为 P0,反应达 平衡时总压强为 P1,则平衡时甲烷的转化率为 ____________________________ (忽略副反应)。
(5)将 1molCH4(g) 和 1molH2O(g)加入恒温恒压的密闭容器中(温度 298K、压强 100kPa),发生反应Ⅰ,不考虑 反应Ⅱ的发生,该反应中,正反应速率 v 正=k 正×p(CH4)×p(H2O) , 逆反应速率 v 逆=k 逆×p(CO)×p3(H2),其中 k 正、k 逆 为速率常数,p 为分压(分压=总压×物质的量分数),则该反应的压强平衡常数 Kp= ____________________________ (以 k 正、k 逆表示)。若 该条件下 k 正=4.4×104kPa-1·s-1,当 CH4 分解 20%时,v 正= ___________________________kPa·s-1(保留两位有效数字)。
【答案】CH4(g)+2H2O![]() CO2(g)+4H2(g) H = +169 kJ/mol AC b
CO2(g)+4H2(g) H = +169 kJ/mol AC b ![]() k正/k逆 4.9×107
k正/k逆 4.9×107
【解析】
(1)根据盖斯定律书写热化学方程式;
(2)反应达到平衡状态时,正反应速率等于逆反应速率,各物质的浓度、体积分数、物质的量分数等物理量不变,据此分析;
(3)增加 CO 转化率,平衡正向移动;
(4)根据反应方程式计算,平衡体系总压为各组分分压之和;
(5)根据正反应速率 v 正=k 正×p(CH4)×p(H2O) , 逆反应速率 v 逆=k 逆×p(CO)×p3(H2)以及Kp= 进行计算。
进行计算。
(1)根据盖斯定律反应Ⅰ+反应Ⅱ得:CH4(g)+2H2O![]() CO2(g)+4H2(g) H = +169 kJ/mol;
CO2(g)+4H2(g) H = +169 kJ/mol;
(2)A. 该反应为非等体积反应,压强不再改变,反应达到平衡状态,A项正确;
B.速率之比在任何时候都等于化学计量数之比,不一定是平衡状态,B项错误;
C. 该反应为非等体积反应,平均相对分子质量不再改变, 反应达到平衡状态,C项正确;
D. 反应中质量守恒,气体总质量不变,气体体积不变,密度始终不变,不能证明达到平衡状态,D项错误;
但选AC;
(3)a.该反应为放热反应,升高温度 ,平衡逆向移动,CO 转化率减小,a项错误;
b.将 CO2 从体系分离,减小了生成物的浓度,平衡正向移动,b项正确;
c.充入 He,使体系总压强增大,但各物质的浓度不变,平衡不移动,转化率不变,c项错误;
d.按原投料比加倍投料,新平衡与原平衡等效,转化率不变,d项错误;
答案选b;
(4)设反应中转化的压强为x,则
CH4(g) + H2O(g) ![]() CO(g) + 3H2(g)
CO(g) + 3H2(g)
起始压强 ![]()
![]() 0 0
0 0
转化压强 x x x 3x
平衡压强 ![]() -x
-x ![]() -x x 3x
-x x 3x
![]() -x+
-x+![]() -x+x+3x=P1,解得x=
-x+x+3x=P1,解得x=![]() ,平衡时甲烷的转化率为
,平衡时甲烷的转化率为 ×100%=
×100%=![]() ×100%=(
×100%=(![]() -1) ×100%;
-1) ×100%;
(5)正反应速率 v 正=k 正×p(CH4)×p(H2O) , 逆反应速率 v 逆=k 逆×p(CO)×p3(H2),则p(CH4)×p(H2O)=![]() ,p(CO)×p3(H2)=
,p(CO)×p3(H2)=![]() ,Kp=
,Kp= =
=![]() ,达到平衡状态时v(正)=v(逆),因此Kp=
,达到平衡状态时v(正)=v(逆),因此Kp= =
=![]() ;当 CH4 分解 20%时,
;当 CH4 分解 20%时,
CH4(g) + H2O(g) ![]() CO(g) + 3H2(g)
CO(g) + 3H2(g)
起始(mol) 1 1 0 0
转化(mol) 0.2 0.2 0.2 0.6
平衡(mol) 0.8 0.8 0.2 0.6
平衡时甲烷的物质的量分数为![]() =
=![]() ,水蒸气的物质的量分数为
,水蒸气的物质的量分数为![]() =
=![]() ,
,
则p(CH4)=100kPa×![]() =
=![]() kPa,p(H2O)= 100kPa×
kPa,p(H2O)= 100kPa×![]() =
=![]() kPa,又v 正=k 正×p(CH4)×p(H2O),当k 正=4.4×104kPa-1·s-1时,v 正=4.4×104×
kPa,又v 正=k 正×p(CH4)×p(H2O),当k 正=4.4×104kPa-1·s-1时,v 正=4.4×104×![]() ×
×![]() =4.9×107 kPa·s-1。
=4.9×107 kPa·s-1。


科目:高中化学 来源: 题型:
【题目】Bodensteins 研究了反应 2HI(g)![]() I2(g)+ H2(g),某温度下,上述反应中,正反应速率为υ正=k正c2(HI),逆反应速率为υ逆=k逆c(I2)·c(H2),,其中k正、k逆为速率常数,根据以上内容得出的结论,不正确的是
I2(g)+ H2(g),某温度下,上述反应中,正反应速率为υ正=k正c2(HI),逆反应速率为υ逆=k逆c(I2)·c(H2),,其中k正、k逆为速率常数,根据以上内容得出的结论,不正确的是
A.反应物浓度越大,正反应速率越大
B.生成物浓度越大,逆反应速率越大
C.该反应的平衡常数K =k正/k逆
D.速率常数的大小与反应程度无关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中,可以有如下两种方法制备二氧化氯(ClO2),回答下列问题
Ⅰ.![]()
Ⅱ.![]()
(1)NaClO3中Cl的化合价为______________。
(2)Ⅰ中还原产物是______________。
(3)Ⅱ的离子方程式为__________________________________________,若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为_____________L。
(4)二氧化氯是一种在水处理等方面有广泛应用的高效安全消毒剂。“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力(得失电子数)相当于多少克C12的氧化能力(Cl均转化为Cl-)。ClO2的有效氯含量为_________________(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.用冷却结晶法来提纯含有少量氯化钾杂质的硝酸钾晶体
B.检验溶液中存在![]() 的常用方法是:往溶液中加入KSCN溶液,溶液不变色;再滴入新制氯水,溶液变成血红色
的常用方法是:往溶液中加入KSCN溶液,溶液不变色;再滴入新制氯水,溶液变成血红色
C.将石油裂化产物通入溴水中,可观察到液体分层且上下两层均为无色
D.进行淀粉水解实验时,为检验水解产物和水解是否完全,加液顺序通常如下:淀粉溶液![]() 溶液
溶液![]() 溶液
溶液![]() 碘水
碘水![]() 新制
新制![]() 悬浊液
悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组采用下图实验装置及相应操作制取纯碱。实验时,广口瓶中反应的化学方程式为:NH3+CO2+H2O+NaCl= NaHCO3↓+NH4Cl。下列分析正确的是

A. 导气管乙应该通入氨气
B. 导气管甲应先于乙通入气体
C. 干燥管中应盛装碱石灰
D. 广口瓶最好置于热水浴中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6molX气体和0.4molY气体混合于2L容器中,发生反应:3X(g)+Y(g)= nZ(g) +2W(g).5min末已生成0.2molW,若测知以Z浓度的变化来表示平均速率为0.01mol/(L·min),则
(1)上述反应Z气体的计量系数n的值是______;
(2)上述反应在5min末时,已用去的Y占原来物质的质分数是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应方程式书写正确且为加成反应的是( )
A.CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B.CH2=CH2+Br2→CH3-CHBr2
C.CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
D.![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】因在航空、核能、电池等高技术领域的重要作用——锂被称为“21世纪的能源金属”。完成下列填空:
(1)锂位于元素周期表的________。锂的很多化学性质与镁相似,请依据元素周期律进行解释:_________。
(2)氢化锂(LiH)是离子化合物,写出其阴离子的电子式_______________,LiH中阴离子半径大于阳离子半径,其原因是__________________________________________________。
(3) 工业上用Li2CO3制取锂的化合物及金属锂。碳原子核外电子有________种不同能量的电子,其中有两个电子的能量最高且能量相等,这两个电子所处的轨道是_____________________。
(4)用Li2CO3、氨水和液溴制备LiBr·H2O的流程如下:

①合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:
Li2CO3+Br2+ NH3·H2O→LiBr+(___) __________。
②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到LiBr·H2O晶体的实验步骤:_____、过滤、用乙醇洗涤,干燥。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,配制一组c(H2A)+c(HA-)+c(A2-)=0.10mol·L-1的H2A和NaOH的混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法中正确的是( )
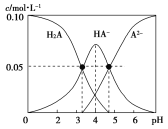
A.在c(Na+)=0.10mol·L-1的溶液中:c(A2-)-c(H+)=c(H2A)-c(OH-)
B.pH=4的溶液中:c(HA-)=c(H2A)+c(A2-)
C.pH=7的溶液中:c(Na+)=c(A2-)+c(HA-)
D.Ka1(H2A)的数量级为10-5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com