
【题目】Bodensteins 研究了反应 2HI(g)![]() I2(g)+ H2(g),某温度下,上述反应中,正反应速率为υ正=k正c2(HI),逆反应速率为υ逆=k逆c(I2)·c(H2),,其中k正、k逆为速率常数,根据以上内容得出的结论,不正确的是
I2(g)+ H2(g),某温度下,上述反应中,正反应速率为υ正=k正c2(HI),逆反应速率为υ逆=k逆c(I2)·c(H2),,其中k正、k逆为速率常数,根据以上内容得出的结论,不正确的是
A.反应物浓度越大,正反应速率越大
B.生成物浓度越大,逆反应速率越大
C.该反应的平衡常数K =k正/k逆
D.速率常数的大小与反应程度无关系
 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有CO32-,其原因是____。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图1和图2所示。


①以酚酞为指示剂(变色范围pH8.0~10.0),将NaOH溶液逐滴加入H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为____。
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=___(pKa1=-lgKa1)。
H2AsO4-+H+的电离常数为Ka1,则pKa1=___(pKa1=-lgKa1)。
(3)溶液的pH对吸附剂X表面所带电荷有影响。pH=7.1时,吸附剂X表面不带电荷;pH>7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如图3所示。

①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是___。
②吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为___,提高吸附剂X对三价砷去除效果可采取的措施是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应 A2+B2 = 2AB 的能量变化如图所示,则下列说法正确的是( )

A.该反应是吸热反应
B.断裂1molA-A键和1molB-B键能放出x kJ 的能量
C.2molAB的总能量高1mol A2和1molB2和的总能量
D.断裂2molA-B键需要吸收y kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌及其化合物的性质与铝及其化合物相似。如图横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4 ]2-的物质的量浓度的对数。25℃时,下列说法中不正确的是

A. 往ZnCl2溶液中加入过量氢氧化钠溶液,反应的离子方程式为Zn2++4OH-=[Zn(OH)4]2-
B. 若要从某废液中完全沉淀Zn2+,通常可以调控该溶液的pH在8.0—12.0之间
C. pH=8.0与pH=12.0的两种废液中,Zn2+浓度之比为108
D. 该温度时,Zn(OH)2的溶度积常数(Ksp)为1×l0-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁可以和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.下列说法中正确的是
FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.下列说法中正确的是

A. a点为平衡状态
B. b点和c点的化学平衡常数K相同
C. 该反应的化学平衡常数表示为K =[CO]·[FeO]/[CO2]·[Fe]
D. 若温度升高,该反应的化学平衡常数K增大,则该反应的 ΔH < 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置的叙述,正确的是( )
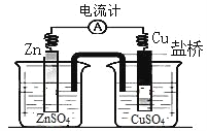
A.铜做正极,铜片上有气泡产生
B.盐桥中的阴离子会移向 CuSO4 溶液
C.正极附近的 SO![]() 浓度逐渐增大
浓度逐渐增大
D.锌片表面被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应的速率和限度对人类生产生活有重要的意义。
(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响,设计实验如下(所取溶液体积均为2 mL):
实验编号 | 温度/℃ | c(Na2S2O3)/mol·L-1 | c(H2SO4)/mol·L-1 |
Ⅰ | 25 | 0.1 | 0.1 |
Ⅱ | 25 | 0.2 | 0.1 |
Ⅲ | 50 | 0.2 | 0.1 |
①上述实验中溶液最先变浑浊的是______(填实验编号,下同)。
②为探究浓度对化学反应速率的影响,应选择______和______。
(2)某温度下,在1 L密闭容器中,发生反应:2X(g)+Y(g)![]() 2Z(g),X的物质的量随时间的变化如下表:
2Z(g),X的物质的量随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
X的物质的量/mol | 0.02 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
①用X的浓度变化表示0~2 s的平均化学反应速率为______mol/(L·s)。
②在3 s以后X的浓度不再改变,反应达到了______状态。
③能说明该反应已达到化学平衡状态的是______(填序号)。
A.v正(X)=v逆(X)
B.单位时间内有2 mol X生成同时有1 mol Y生成
C.X、Y、Z的分子数之比为2∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证还原性:SO2>Fe2+>Cl-,三组同学分别进行了下图实验,并对溶液1和溶液2中所含离子进行了检验,能证明上述还原性顺序的实验组有( )
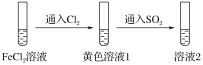
溶液1 | 溶液2 | |
甲 | 含Fe3+、Fe2+ | 含SO |
乙 | 含Fe3+,无Fe2+ | 含SO |
丙 | 含Fe3+,无Fe2+ | 含Fe2+ |
A.只有甲B.甲、乙
C.甲、丙D.甲、乙、丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在工业上常作为重要的化工原料,其混合气称为合成气。工业上CH4—H2O 催化重整是目前大规模制取合成气的重要方法,其原理为:
反应Ⅰ:CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1 = +210kJ/mol
CO(g)+3H2(g) H1 = +210kJ/mol
反应Ⅱ:CO(g)+ H2O(g)![]() CO2(g)+H2(g) H2 =﹣41kJ/mol
CO2(g)+H2(g) H2 =﹣41kJ/mol
(1)CH4(g)、H2O(g)反应生成 CO2(g)、H2(g)的热化学方程式是 ___________________________。
(2)反应Ⅰ达到平衡的标志是(____________)
a.恒温恒容情况下,压强不再改变 b. v(CO):v(H2)=1:3
c.平均相对分子质量不再改变 d.恒温恒容情况下,气体密度不再改变
(3)若容器容积不变,不考虑反应Ⅰ,对反应Ⅱ下列措施可增加 CO 转化率的是(____________)
a.升高温度 b.将 CO2 从体系分离 c.充入 He,使体系总压强增大 d.按原投料比加倍投料
(4)某温度下,对于反应Ⅰ,将 n(H2O)∶n(CH4) = 1∶1 的原料气充入恒容密闭容器中,初始压强为 P0,反应达 平衡时总压强为 P1,则平衡时甲烷的转化率为 ____________________________ (忽略副反应)。
(5)将 1molCH4(g) 和 1molH2O(g)加入恒温恒压的密闭容器中(温度 298K、压强 100kPa),发生反应Ⅰ,不考虑 反应Ⅱ的发生,该反应中,正反应速率 v 正=k 正×p(CH4)×p(H2O) , 逆反应速率 v 逆=k 逆×p(CO)×p3(H2),其中 k 正、k 逆 为速率常数,p 为分压(分压=总压×物质的量分数),则该反应的压强平衡常数 Kp= ____________________________ (以 k 正、k 逆表示)。若 该条件下 k 正=4.4×104kPa-1·s-1,当 CH4 分解 20%时,v 正= ___________________________kPa·s-1(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com