
【题目】为验证还原性:SO2>Fe2+>Cl-,三组同学分别进行了下图实验,并对溶液1和溶液2中所含离子进行了检验,能证明上述还原性顺序的实验组有( )
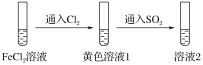
溶液1 | 溶液2 | |
甲 | 含Fe3+、Fe2+ | 含SO |
乙 | 含Fe3+,无Fe2+ | 含SO |
丙 | 含Fe3+,无Fe2+ | 含Fe2+ |
A.只有甲B.甲、乙
C.甲、丙D.甲、乙、丙
【答案】C
【解析】
本实验利用“还原剂的还原性大于还原产物”的原理来验证还原性的强弱顺序。向FeCl2溶液中通入Cl2,得到溶液1,再向溶液1中通入SO2,得到溶液2。
甲.溶液1中含有Fe3+、Fe2+,说明发生反应2Fe2++Cl2=2Fe3++2Cl-,且Cl2反应完全,可证明还原性Fe2+>Cl-;溶液2中含有SO42-,则说明发生反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,可证明还原性SO2>Fe2+,故甲能证明还原性SO2>Fe2+>Cl-;
乙.溶液1中含有Fe3+,无Fe2+剩余,则还原性Fe2+>Cl-,但Cl2可能过量,再通入SO2,可能发生的反应是Cl2+SO2+2H2O=2Cl-+SO42-+4H+,不能比较SO2与Fe2+的还原性强弱,故乙不能验证;
丙.溶液1中含有Fe3+,没有Fe2+,通入SO2后溶液中又含有Fe2+,说明SO2将Fe3+还原得到Fe2+,证明还原性SO2>Fe2+,故丙实验结论能证明还原性SO2>Fe2+>Cl-。
综上所述,答案为C。


科目:高中化学 来源: 题型:
【题目】常温下,在20mL0.1mol/L HR 溶液中滴加0.1000mol/LNaOH溶液,混合溶液的PH与所加NaOH溶液体积的关系如图所示。下列推断正确的是

A. ①、②、③三点中,③对应的溶液中c水(H+)·c水(OH-)最大
B. HR溶液中只存在H+、R-、OH-、H2O四种微粒
C. ②点溶液中一定存在c(Na+)>c(R-)>c(H+)=c(OH-)
D. NaR的水解常数Ka和水解程度:③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Bodensteins 研究了反应 2HI(g)![]() I2(g)+ H2(g),某温度下,上述反应中,正反应速率为υ正=k正c2(HI),逆反应速率为υ逆=k逆c(I2)·c(H2),,其中k正、k逆为速率常数,根据以上内容得出的结论,不正确的是
I2(g)+ H2(g),某温度下,上述反应中,正反应速率为υ正=k正c2(HI),逆反应速率为υ逆=k逆c(I2)·c(H2),,其中k正、k逆为速率常数,根据以上内容得出的结论,不正确的是
A.反应物浓度越大,正反应速率越大
B.生成物浓度越大,逆反应速率越大
C.该反应的平衡常数K =k正/k逆
D.速率常数的大小与反应程度无关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业在工农业生产、生活中有着重要作用。反应原理为:3H2(g)+N2(g)![]() 2NH3(g) △H < 0。
2NH3(g) △H < 0。
(1)在T ℃时,将一定物质的量的H2和N2置于一容积不变的密闭容器中。
①下列各项能说明该反应已达到平衡状态的是__________(填序号)。
a.容器内的压强不再随时间变化
b.3υ(N2)=υ(H2)
c.3υ正(H2)=2υ逆(NH3)
d.混合气体的密度保持不变
②达上述平衡后,其他条件不变,升高温度,υ逆___________________(填“增大”、“不变”、“减小”),υ正和υ逆的关系为υ正___________υ逆(填:“>”、“=”、“<”),最后二者相等。
③该条件下达到平衡时,向容器内充入惰性气体,增大容器内的压强,NH3的体积分数将(填:“变大”、“不变”或“变小”)。________
(2)在T ℃时,将一定物质的量的H2和N2置于一容积可变的密闭容器中。达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改变的条件可能是______。
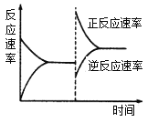
a.升高温度,同时加压b.降低温度,同时减压
c.保持温度、压强不变,增大反应物浓度
d.保持温度、压强不变,减小生成物浓度
(3)在T ℃时,将0.6 mol H2和0.4 mol N2置于容积为2 L的密闭容器中发生反应:3H2(g)+N2(g)![]() 2NH3 (g) △H <0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强(MPa)随时间变化如图所示:8 min内NH3的平均生成速率为_______。
2NH3 (g) △H <0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强(MPa)随时间变化如图所示:8 min内NH3的平均生成速率为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电解质溶液有关叙述正确的是
A.恒温条件下稀释氢氟酸时,HF的Ka增大,水的KW不变
B.向Mg(OH)2沉淀悬浊液中加入NH4Cl固体,c(Mg2+)、c(OH-)浓度均增大
C.0.1mol/LNaHCO3溶液中,c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2CO3)
)>c(H2CO3)
D.0.1mol/LNa2SO3溶液中,加入少量NaOH固体,c(![]() )与c(Na+)均增大
)与c(Na+)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是( )
①电离程度增大 ②c(NH3·H2O)增大 ③NH![]() 数目增多 ④c(OH-)增大 ⑤导电性增强
数目增多 ④c(OH-)增大 ⑤导电性增强
A.①②③ B.①③⑤ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中,可以有如下两种方法制备二氧化氯(ClO2),回答下列问题
Ⅰ.![]()
Ⅱ.![]()
(1)NaClO3中Cl的化合价为______________。
(2)Ⅰ中还原产物是______________。
(3)Ⅱ的离子方程式为__________________________________________,若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为_____________L。
(4)二氧化氯是一种在水处理等方面有广泛应用的高效安全消毒剂。“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力(得失电子数)相当于多少克C12的氧化能力(Cl均转化为Cl-)。ClO2的有效氯含量为_________________(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.用冷却结晶法来提纯含有少量氯化钾杂质的硝酸钾晶体
B.检验溶液中存在![]() 的常用方法是:往溶液中加入KSCN溶液,溶液不变色;再滴入新制氯水,溶液变成血红色
的常用方法是:往溶液中加入KSCN溶液,溶液不变色;再滴入新制氯水,溶液变成血红色
C.将石油裂化产物通入溴水中,可观察到液体分层且上下两层均为无色
D.进行淀粉水解实验时,为检验水解产物和水解是否完全,加液顺序通常如下:淀粉溶液![]() 溶液
溶液![]() 溶液
溶液![]() 碘水
碘水![]() 新制
新制![]() 悬浊液
悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】因在航空、核能、电池等高技术领域的重要作用——锂被称为“21世纪的能源金属”。完成下列填空:
(1)锂位于元素周期表的________。锂的很多化学性质与镁相似,请依据元素周期律进行解释:_________。
(2)氢化锂(LiH)是离子化合物,写出其阴离子的电子式_______________,LiH中阴离子半径大于阳离子半径,其原因是__________________________________________________。
(3) 工业上用Li2CO3制取锂的化合物及金属锂。碳原子核外电子有________种不同能量的电子,其中有两个电子的能量最高且能量相等,这两个电子所处的轨道是_____________________。
(4)用Li2CO3、氨水和液溴制备LiBr·H2O的流程如下:

①合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:
Li2CO3+Br2+ NH3·H2O→LiBr+(___) __________。
②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到LiBr·H2O晶体的实验步骤:_____、过滤、用乙醇洗涤,干燥。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com