
،¾جâؤ؟،؟شعتµرéتزضذ£¬؟ةزشسذبçدآء½ضض·½·¨ضئ±¸¶رُ»¯آب(ClO2)£¬»ط´ًدآءذختجâ
¢ٌ.![]()
¢ٍ.![]()
(1)NaClO3ضذClµؤ»¯؛د¼غخھ______________،£
(2)¢ٌضذ»¹ش²ْخïتا______________،£
(3)¢ٍµؤہë×س·½³جت½خھ__________________________________________£¬بô·´س¦ضذسذ0.1molµç×س×ھزئ£¬شٍ²ْةْµؤClO2ئّجهشع±ê×¼×´؟ِدآµؤجه»خھ_____________L،£
(4)¶رُ»¯آبتاز»ضضشعث®´¦ہيµب·½أوسذ¹م·؛س¦سأµؤ¸كذ§°²ب«دû¶¾¼ء،£،°سذذ§آب؛¬ء؟،±؟ةسأہ´؛âء؟؛¬آبدû¶¾¼ءµؤدû¶¾ؤـء¦£¬ئن¶¨زهتا£؛أ؟؟ث؛¬آبدû¶¾¼ءµؤرُ»¯ؤـء¦(µأت§µç×ست)د൱سع¶àةظ؟ثC12µؤرُ»¯ؤـء¦(Cl¾ù×ھ»¯خھCl-)،£ClO2µؤسذذ§آب؛¬ء؟خھ_________________(¼ئثم½ل¹û±£ءôء½خ»ذ،ت)
،¾´ً°¸،؟+5 ClO2 2ClO3-+H2O2+2H+=2ClO2،ü+O2،ü+2H2O 2.24 2.63g
،¾½âخِ،؟
¸ù¾فص¸؛»¯؛د¼غ´ْت؛حخھ0¼ئثم£»¸ù¾فرُ»¯»¹ش·´س¦µؤ¸إؤî½ل؛دشھثطµؤ»¯؛د¼غ±ن»¯·ضخِإذ¶د£»½ل؛دµç×س×ھزئµؤتؤ؟¼ئثم£»¸ù¾فµç×ستط؛م¹وآة¼ئثم،£
(1)NaClO3ضذNaخھ+1¼غ£¬Oخھ-2¼غ£¬سةص¸؛»¯؛د¼غ´ْت؛حخھ0؟ةضھClµؤ»¯؛د¼غخھ+5¼غ£»
(2)¢ٌضذClشھثط´س+5¼غ½µخھ+4¼غ£¬´س-1¼غة¸كخھ0¼غ£¬شٍ»¹ش²ْخïتاClO2£»
(3)¢ٍµؤہë×س·½³جت½خھ2ClO3-+H2O2+2H+=2ClO2،ü+O2،ü+2H2O£¬·´س¦ضذClشھثط´س+5¼غ½µخھ+4¼غ£¬شٍأ؟ةْ³ة1molClO2×ھزئ1molµç×س£¬دض·´س¦ضذسذ0.1molµç×س×ھزئ£¬²ْةْµؤClO2ئّجهµؤخïضتµؤء؟خھ0.1mol£¬شع±ê×¼×´؟ِدآµؤجه»خھ0.1mol،ء22.4L/mol=2.24L£»
(4) ¸ù¾فسذذ§آب¶¨زه£¬1gClO2µؤخïضتµؤء؟خھ![]() mol£¬زرضھClO2،«Cl-،«5e-£¬شٍ×ھزئµç×سخھ
mol£¬زرضھClO2،«Cl-،«5e-£¬شٍ×ھزئµç×سخھ![]() mol£¬زرضھCl2،«2Cl-،«2e-£¬زہ¾فµç×س×ھزئتؤ؟دàµب£¬؟ةضھآبئّµؤخïضتµؤء؟خھ
mol£¬زرضھCl2،«2Cl-،«2e-£¬زہ¾فµç×س×ھزئتؤ؟دàµب£¬؟ةضھآبئّµؤخïضتµؤء؟خھ![]() ،ء
،ء![]() mol£¬شٍآبئّµؤضتء؟خھ
mol£¬شٍآبئّµؤضتء؟خھ![]() ،ء
،ء![]() mol،ء71g/mol=2.63g،£
mol،ء71g/mol=2.63g،£



| ؤ꼶 | ¸كضذ؟خ³ج | ؤ꼶 | ³ُضذ؟خ³ج |
| ¸كز» | ¸كز»أâ·ر؟خ³جحئ¼ِ£، | ³ُز» | ³ُز»أâ·ر؟خ³جحئ¼ِ£، |
| ¸ك¶ | ¸ك¶أâ·ر؟خ³جحئ¼ِ£، | ³ُ¶ | ³ُ¶أâ·ر؟خ³جحئ¼ِ£، |
| ¸كب | ¸كبأâ·ر؟خ³جحئ¼ِ£، | ³ُب | ³ُبأâ·ر؟خ³جحئ¼ِ£، |
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟»¯ر§·´س¦ A2+B2 = 2AB µؤؤـء؟±ن»¯بçح¼ثùت¾£¬شٍدآءذثµ·¨صب·µؤتا£¨ £©

A.¸أ·´س¦تاخüبب·´س¦
B.¶دءر1molA-A¼ü؛ح1molB-B¼üؤـ·إ³ِx kJ µؤؤـء؟
C.2molABµؤ×ـؤـء؟¸ك1mol A2؛ح1molB2؛حµؤ×ـؤـء؟
D.¶دءر2molA-B¼üذèزھخüتصy kJµؤؤـء؟
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟»¯ر§·´س¦µؤثظآت؛حدق¶ب¶شبثہàةْ²ْةْ»îسذضطزھµؤزâزه،£
(1)زرضھNa2S2O3£«H2SO4=Na2SO4£«S،£«SO2£«H2O،£¼×ح¬ر§ح¨¹²â¶¨¸أ·´س¦·¢ةْت±بـز؛±ن»ë×اµؤت±¼ن£¬رذ¾؟حâ½çجُ¼¶ش»¯ر§·´س¦ثظآتµؤس°دى£¬ةè¼ئتµرéبçدآ(ثùب،بـز؛جه»¾ùخھ2 mL)£؛
تµرé±à؛إ | خآ¶ب/،و | c(Na2S2O3)/mol،¤L£1 | c(H2SO4)/mol،¤L£1 |
¢ٌ | 25 | 0.1 | 0.1 |
¢ٍ | 25 | 0.2 | 0.1 |
¢َ | 50 | 0.2 | 0.1 |
¢ظةدتِتµرéضذبـز؛×îدب±ن»ë×اµؤتا______£¨جîتµرé±à؛إ£¬دآح¬£©،£
¢عخھج½¾؟إ¨¶ب¶ش»¯ر§·´س¦ثظآتµؤس°دى£¬س¦ر،شٌ______؛ح______،£
(2)ؤ³خآ¶بدآ£¬شع1 Lأـ±صبفئ÷ضذ£¬·¢ةْ·´س¦£؛2X(g)£«Y(g)![]() 2Z(g)£¬Xµؤخïضتµؤء؟ثوت±¼نµؤ±ن»¯بçدآ±ي£؛
2Z(g)£¬Xµؤخïضتµؤء؟ثوت±¼نµؤ±ن»¯بçدآ±ي£؛
ت±¼ن/s | 0 | 1 | 2 | 3 | 4 | 5 |
Xµؤخïضتµؤء؟/mol | 0.02 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
¢ظسأXµؤإ¨¶ب±ن»¯±يت¾0،«2 sµؤئ½¾ù»¯ر§·´س¦ثظآتخھ______mol/(L،¤s)،£
¢عشع3 sزش؛َXµؤإ¨¶ب²»شظ¸ؤ±ن£¬·´س¦´ïµ½ءث______×´ج¬،£
¢غؤـثµأ÷¸أ·´س¦زر´ïµ½»¯ر§ئ½؛â×´ج¬µؤتا______(جîذٍ؛إ)،£
A£®vص(X)=vؤو(X)
B£®µ¥خ»ت±¼نؤعسذ2 mol Xةْ³ةح¬ت±سذ1 mol Yةْ³ة
C£®X،¢Y،¢Zµؤ·ض×ستض®±بخھ2،أ1،أ2
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟خھرéض¤»¹شذش£؛SO2>Fe2£«>Cl££¬ب×éح¬ر§·ض±ً½ّذذءثدآح¼تµر飬²¢¶شبـز؛1؛حبـز؛2ضذثù؛¬ہë×س½ّذذءث¼ىر飬ؤـض¤أ÷ةدتِ»¹شذشث³ذٍµؤتµرé×éسذ(،،،،)
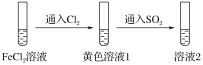
بـز؛1 | بـز؛2 | |
¼× | ؛¬Fe3£«،¢Fe2£« | ؛¬SO |
زز | ؛¬Fe3£«£¬خقFe2£« | ؛¬SO |
±û | ؛¬Fe3£«£¬خقFe2£« | ؛¬Fe2£« |
A.ض»سذ¼×B.¼×،¢زز
C.¼×،¢±ûD.¼×،¢زز،¢±û
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟¶رُ»¯ءٍ،ھ؟صئّضت×س½»»»ؤ¤ب¼ءدµç³ط½«»¯ر§ؤـ×ھ±ن³ةµçؤـµؤح¬ت±£¬تµدضءثضئءٍثل،¢·¢µç،¢»·±£بخ»ز»جهµؤ½ل؛د£¬½µµحءث³ة±¾جل¸كءثذ§زو£¬ئنشہيبçح¼ثùت¾،£دآءذثµ·¨´يخَµؤتا£¨ £©

A.Pt1 ¸½½üµؤµç¼«·´س¦ت½خھ SO2+2H2O2e¨T2H2SO4
B.Pt2 ¸½½üµؤµç¼«·´س¦ت½خھ O2+4H++4e¨T2H2O
C.¸أµç³ط·إµçت±µç×س´س Pt1 µç¼«¾¹حâµçآ·ء÷µ½ Pt2 µç¼«
D.دàح¬جُ¼دآ£¬·إµç¹³جضذدû؛ؤµؤ SO2 ؛ح O2 µؤجه»±بخھ 2:1
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟³£خآدآ£¬دآءذبـز؛ضذ¸÷خ¢ء£إ¨¶ب¹طدµصب·µؤتا£¨ £©
A.دٍ°±ث®ضذµخ¼سد،ءٍثلضءبـز؛³تضذذش£؛c(NH4+)=c(SO![]() )£¾c(OH-)=c(H+)
)£¾c(OH-)=c(H+)
B.دٍ l00mL 3 mol/L µؤ NaOH بـز؛ضذح¨بë±ê×¼×´؟ِدآجه»خھ 4.48L µؤ CO2£؛3c(Na+)=2[c(CO3 2-)+c(HCO3-)+c(H2CO3)]
C.CH3COONa بـز؛ضذ¼سبëةظء؟ KNO3 ؛َبـز؛ز»¶¨سذ£؛c(Na+)+c(H+)=(CH3COO ز»)+c(OH ز»)
D.µبخïضتµؤء؟إ¨¶بµؤ¢ظNH4HSO4،¢¢عNH4HCO3،¢¢غNH4Cl بـز؛ضذ£¬c(NH4+)µؤ´َذ،¹طدµ£؛¢ظ£¾¢ع£¾¢غ
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟بçح¼تازشت¯ؤ«×÷رô¼«£¬ح°ô×÷زُ¼«£¬µç½â 200mL£¬؛¬سذ Cu2+،¢Fe3+ہë×سµؤثلذشبـز؛£¬زُ¼«ةْ³ة¹ججهسë×ھزئµç×سµؤ¹طدµ£¬ شٍزشدآثµ·¨صب·µؤتا£¨ £©
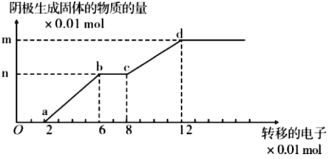
A.Oa ¶خ،¢bc ¶خزُ¼«¾ùسذئّجه²ْةْ
B.bc ¶خµؤµç¼«·´س¦خھ£؛Fe3++e-=Fe2+
C.شبـز؛ PH ضµش¼خھ 1
D.¸أبـز؛ضذ Cu2+£¬Fe3+ہë×سµؤإ¨¶بض®±بخھ 1:2
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟CO؛حH2شع¹¤زµةد³£×÷خھضطزھµؤ»¯¹¤شءد£¬ئن»ى؛دئّ³ئخھ؛د³ةئّ،£¹¤زµةدCH4،ھH2O ´ك»¯ضطصûتاؤ؟ا°´َ¹وؤ£ضئب،؛د³ةئّµؤضطزھ·½·¨£¬ئنشہيخھ£؛
·´س¦¢ٌ£؛CH4(g)+H2O(g)![]() CO(g)+3H2(g) H1 = +210kJ/mol
CO(g)+3H2(g) H1 = +210kJ/mol
·´س¦¢ٍ£؛CO(g)+ H2O(g)![]() CO2(g)+H2(g) H2 =©پ41kJ/mol
CO2(g)+H2(g) H2 =©پ41kJ/mol
£¨1£©CH4(g)،¢H2O(g)·´س¦ةْ³ة CO2(g)،¢H2(g)µؤبب»¯ر§·½³جت½تا ___________________________،£
£¨2£©·´س¦¢ٌ´ïµ½ئ½؛âµؤ±êض¾تا£¨____________£©
a.؛مخآ؛مبفاé؟ِدآ£¬ر¹ا؟²»شظ¸ؤ±ن b. v(CO):v(H2)=1:3
c.ئ½¾ùدà¶ش·ض×سضتء؟²»شظ¸ؤ±ن d.؛مخآ؛مبفاé؟ِدآ£¬ئّجهأـ¶ب²»شظ¸ؤ±ن
£¨3£©بôبفئ÷بف»²»±ن£¬²»؟¼آا·´س¦¢ٌ£¬¶ش·´س¦¢ٍدآءذ´ëت©؟ةشِ¼س CO ×ھ»¯آتµؤتا£¨____________£©
a£®ة¸كخآ¶ب b£®½« CO2 ´سجهدµ·ضہë c£®³نبë He£¬ت¹جهدµ×ـر¹ا؟شِ´َ d£®°´شح¶ءد±ب¼س±¶ح¶ءد
£¨4£©ؤ³خآ¶بدآ£¬¶شسع·´س¦¢ٌ£¬½« n(H2O)،أn(CH4) = 1،أ1 µؤشءدئّ³نبë؛مبفأـ±صبفئ÷ضذ£¬³ُت¼ر¹ا؟خھ P0£¬·´س¦´ï ئ½؛âت±×ـر¹ا؟خھ P1£¬شٍئ½؛âت±¼×حéµؤ×ھ»¯آتخھ ____________________________ (؛ِآش¸±·´س¦)،£
£¨5£©½« 1molCH4(g) ؛ح 1molH2O(g)¼سبë؛مخآ؛مر¹µؤأـ±صبفئ÷ضذ(خآ¶ب 298K،¢ر¹ا؟ 100kPa)£¬·¢ةْ·´س¦¢ٌ£¬²»؟¼آا ·´س¦¢ٍµؤ·¢ةْ£¬¸أ·´س¦ضذ£¬ص·´س¦ثظآت v ص=k ص،ءp(CH4)،ءp(H2O) , ؤو·´س¦ثظآت v ؤو=k ؤو،ءp(CO)،ءp3(H2)£¬ئنضذ k ص،¢k ؤو خھثظآت³£ت£¬p خھ·ضر¹(·ضر¹=×ـر¹،ءخïضتµؤء؟·ضت)£¬شٍ¸أ·´س¦µؤر¹ا؟ئ½؛â³£ت Kp= ____________________________ (زش k ص،¢k ؤو±يت¾)،£بô ¸أجُ¼دآ k ص=4.4،ء104kPa-1،¤s-1,µ± CH4 ·ض½â 20%ت±£¬v ص= ___________________________kPa،¤s-1£¨±£ءôء½خ»سذذ§ت×ض£©،£
²é؟´´ً°¸؛ح½âخِ>>
؟ئؤ؟£؛¸كضذ»¯ر§ ہ´ش´£؛ جâذح£؛
،¾جâؤ؟،؟دآ±يضذµؤتµرé²ظ×÷ؤـ´ïµ½تµرéؤ؟µؤ»ٍؤـµأ³ِدàس¦½لآغµؤتا![]()
ر،دî | تµرé²ظ×÷ | تµرéؤ؟µؤ»ٍ½لآغ |
A | دٍز»¶¨إ¨¶بµؤ |
|
B | ب،ةظء؟ | ¼ىرé |
C | دٍؤ³بـز؛ضذµخ¼س | ثµأ÷شبـز؛ضذز»¶¨؛¬سذ |
D | ½«»ىسذ | ³ب¥ |
A.A
²é؟´´ً°¸؛ح½âخِ>>
¹ْ¼تر§ذ£سإر، - ء·د°²لءذ±ي - تشجâءذ±ي
؛±±ت،»¥ءھحّخ¥·¨؛ح²»ء¼ذإد¢¾ظ±¨ئ½ج¨ | حّةدسذ؛¦ذإد¢¾ظ±¨×¨اّ | µçذإص©ئ¾ظ±¨×¨اّ | ةوہْت·ذéخقض÷زهسذ؛¦ذإد¢¾ظ±¨×¨اّ | ةوئَاضب¨¾ظ±¨×¨اّ
خ¥·¨؛ح²»ء¼ذإد¢¾ظ±¨µç»°£؛027-86699610 ¾ظ±¨ستدن£؛58377363@163.com