
| A. | 硫酸遇明火发热爆炸 | |
| B. | 浓硫酸遇水发热爆炸 | |
| C. | 铁与水反应产生氢气,氢气接触空气后遇明火爆炸 | |
| D. | 稀释后的硫酸与铁反应产生氢气接触明火爆炸 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | c(H+)=10-4mol•L-1的溶液中:NH4+、K+、SO42-、NO3- | |
| B. | 无色溶液中:Na+、Cu2+、Cl-、NO3- | |
| C. | 0.1 mol•L-1AgNO3 溶液:H+、K+、SO42-、I- | |
| D. | 饱和氯水中:Cl-、Na+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
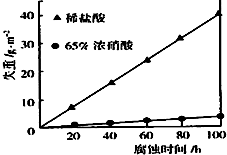 按要求回答下列问题:
按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol乙醚中含有的C-O键的数目为2NA | |
| B. | 标准状况下,44.8CHCl3中含有分子的数目为2NA | |
| C. | 1 mol-CH3中所含的电子总数为10 NA | |
| D. | 向FeI2溶液中通入适量Cl2,当有2 mol Fe2+被氧化时,消耗Cl2的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往某溶液中加入稀NaOH溶液,无刺激性气味的气体产生,说明该溶液一定不含NH4+ | |
| B. | 用加热的方法可以除去混在NaCl固体中的NH4Cl,说明NH4Cl会升华 | |
| C. | SO2气体和Cl2均能使品红溶液褪色,说明两者均有强氧化性 | |
| D. | 浓硫酸可用来干燥H2、Cl2、SO2等气体,说明浓硫酸具有吸水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、HCO${\;}_{3}^{-}$、NO3- | B. | Na+、SO${\;}_{4}^{2-}$、Cl-、ClO- | ||
| C. | H+、Mg2+、SO${\;}_{4}^{2-}$、NO3- | D. | Ag+、K+、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,11.2L氧气中所含有的原子数为NA | |
| B. | 17g的NH3分子中含有的电子数为10NA | |
| C. | 常温常压下,48g O3含有的氧原子数为3NA | |
| D. | 标准状况下,11.2LH2O中所含有的分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com