
 按要求回答下列问题:
按要求回答下列问题:分析 (1)铝与氧化铁发生铝热反应生成氧化铝和铁,据此写出反应的化学方程式;该实验中除用到铝粉和Fe2O3外,需要的试剂还有氯酸钾和镁;
(2)①甲由具有相同电子层结构的阴、阳离子构成,则甲为Al2O3;灼烧得到的红棕色粉末1.60g应该是氧化铁,计算出氧化铁的物质的量,根据铁原子守恒可知铁的物质的量是及质量,从而得出合金中铝的质量,根据n=$\frac{m}{M}$计算出铝物质的量,就可以得出x:y,从而得出乙的化学式;
②在加热的条件下氧化铝与氢氧化钠反应生成Na[Al(OH)]4;由于二氧化硅与能与氢氧化钠反应生成硅酸钠和水,所以含二氧化硅材料做成的坩埚不能用来熔融NaOH;
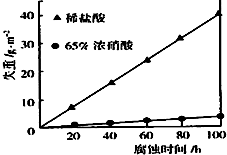
③结合图象可知乙在65%浓硝酸中具有比较强的抗腐蚀性,这是由于常温下遇浓硝酸表面钝化,阻碍进一步反应;
(3)1 mol Mg17Al12完全吸氢后可以吸收17mol氢气,因此释放时可以再释放出17mol氢气,同时镁和铝也分别都能与盐酸反应放出氢气;1 mol Mg17Al12中含有17mol镁、12mol铝,计算出铝和镁与盐酸反应生成的氢气的物质的量,便可得到1mol Mg17Al12完全吸氢后得到的混合物与上述盐酸完全反应,释放出H2的物质的量.
解答 解:(1)铝与氧化铁发生铝热反应的方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;该实验中除用到铝粉和Fe2O3外,需要的试剂还有氯酸钾和镁,故ab正确,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;ab;
(2)①甲由具有相同电子层结构的阴、阳离子构成,则甲是Al2O3;取该合金粉末2.47g,滴加足量浓NaOH溶液,其中铝溶解转化为偏铝酸钠,充分搅拌、过滤、洗涤得固体铁.再将所得固体在空气中充分加热、灼烧得红棕色粉末1.60g,所以红棕色粉末应该是氧化铁,物质的量为:$\frac{1.60g}{160g/mol}$=0.01mol;根据铁原子守恒可知铁的物质的量是0.02mol,质量是0.02mol×56g/mol=1.12g,因此合金中铝的质量是2.47g-1.12g=1.35g,物质的量为:$\frac{1.35g}{27g/mol}$=0.05mol,所以x:y=0.02:0.05=2:5,则乙的化学式为Fe2Al5,
故答案为:Al2O3;2;5;
②在加热的条件下氧化铝与氢氧化钠反应,反应的化学方程式为:Al2O3+2NaOH+3H2O═2Na[Al(OH)]4;
二氧化硅与能与氢氧化钠反应生成硅酸钠和水,所以含二氧化硅材料做成的坩埚不能用来熔融NaOH,
故答案为:Al2O3+2NaOH+3H2O═2Na[Al(OH)]4;不能;
③根据图象可知乙在65%浓硝酸中具有比较强的抗腐蚀性,这是由于常温下遇浓硝酸表面钝化,阻碍进一步反应,
故答案为:65%浓硝酸;遇浓硝酸表面钝化,阻碍进一步反应;
(3)1 mol Mg17Al12完全吸氢后可以吸收17mol氢气,因此释放时可以再释放出17mol氢气,同时镁和铝也分别都能与盐酸反应放出氢气;1 mol Mg17Al12中含有17mol镁、12mol铝,与元素反应分别放出17mol氢气和12mol×$\frac{3}{2}$=18mol氢气,则得到的混合物与上述盐酸完全反应,释放出氢气的物质的量为:17mol+17mol+18mol=52mol,
故答案为:52mol.
点评 本题考查金属镁、铝、铁等有关性质与计算,题目难度中等,注意掌握铝热反应原理及操作方法,明确常见金属单质及其化合物性质,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
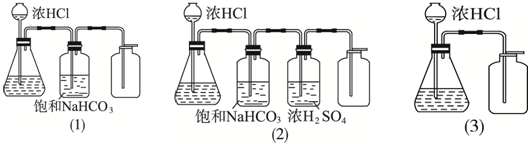
| A. | (1)(2)(3)一样重 | B. | (1)中最重 | C. | (2)中最重 | D. | (3)最轻 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
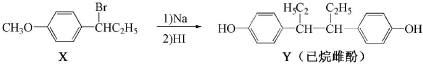
| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件,化合物Y可与HCHO发生缩聚反应 | |
| C. | 用FeCl3溶液可鉴别化合物X和Y | |
| D. | 化合物Y能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
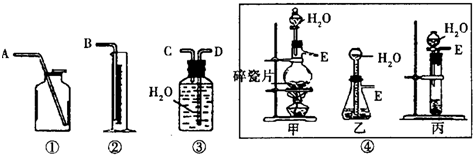
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸遇明火发热爆炸 | |
| B. | 浓硫酸遇水发热爆炸 | |
| C. | 铁与水反应产生氢气,氢气接触空气后遇明火爆炸 | |
| D. | 稀释后的硫酸与铁反应产生氢气接触明火爆炸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
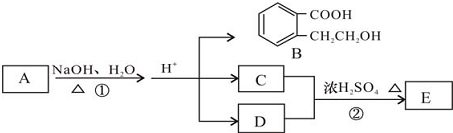
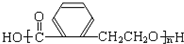 .
.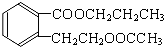 +2 NaOH$\stackrel{△}{→}$
+2 NaOH$\stackrel{△}{→}$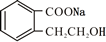 +CH3COONa+CH3CH2CH2OH.
+CH3COONa+CH3CH2CH2OH.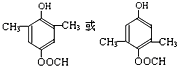 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com