
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置先进行了有关实验:

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。______
(2)实验中他们取6.4g铜片和12mL 18mol·L![]() 浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①请写出铜跟浓硫酸反应的化学方程式:_______。
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:__________。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是_____(填写字母编号)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3)为定量测定余酸的物质的量浓度,甲、乙两学生进行了如下设计:
甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是_____(填写字母编号)。
A.将装置A产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.用排饱和NaHSO3溶液的方法测出装置A产生气体的体积(已折算成标准状况)
【答案】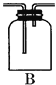
![]() 反应过程中H2SO4被不断消耗,生成的水逐渐增多,使浓硫酸逐渐变稀,至一定浓度就不再与铜片反应; A、D A、B、C
反应过程中H2SO4被不断消耗,生成的水逐渐增多,使浓硫酸逐渐变稀,至一定浓度就不再与铜片反应; A、D A、B、C
【解析】
(1)二氧化硫的密度比空气大;
(2)①浓硫酸有强氧化性;
②稀硫酸与铜不反应;
③氢离子可与铁或碳酸盐反应;
(3)①测定SO2的量必须做到不能在测量时损耗,便于测定分析;
②从滴定实验的两个关键即准确量取液体体积,准确判断反应终点分析判断。
(1)铜跟浓硫酸反应生成了二氧化硫气体,二氧化硫比空气重,可以用向上排气法收集,所以装置中的导气管应长进短出,装置图为: ;
;
(2)①浓硫酸有强氧化性,可与铜反应,故答案为:![]() ;
;
②稀硫酸与铜不反应,随着反应进行,硫酸被消耗,产物有水生成,所以浓硫酸变成稀硫酸;
③A. 根据金属的通性,氢离子能与活泼金属如铁反应,若有氢气生成,则说明有余酸,A正确;
B. 即使没有余酸溶液中也有硫酸根,都能与氯化钡反应生成沉淀,无法确定烧瓶中是否有余酸,B错误;
C. 稀硫酸与银不反应,无法确定烧瓶中是否有余酸;
D. 氢离子能与碳酸盐反应,若有能使澄清的石灰水变浑浊的气体生成,则说明有余酸,故选A、D;
(3)①测定SO2的量必须准确测定无气体损耗,实验操作简单易行;
A. 将装置产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量,由于气体中含有水蒸气,碱石灰会吸收SO2和水蒸气,称量后计算不准确,A项错误;
B. 将装置A产生的气体缓缓通入足量的硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀,过程中沉淀的质量是由SO2被氧化生成的硫酸根离子和酸化高锰酸钾溶液中的硫酸根离子,所以测定不出SO2的含量,B项错误;
C. SO2气体是易溶于水的物质,用排水法测定装置A产生气体的体积不准确,C项错误;
D. 用排饱和NaHSO3溶液的方法测出装置A产生气体的体积,SO2在饱和NaHSO3溶液中的溶解度降低,可以用排水量气方法进行SO2的气体体积测定,D项正确;
故答案为:A、B、C。


科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。用0.1 mol·L-1NaOH溶液滴定20mL 0.1mol·L-1H2SO3溶液的滴定曲线如下图所示(曲线上的数字为pH)。下列说法正确的是
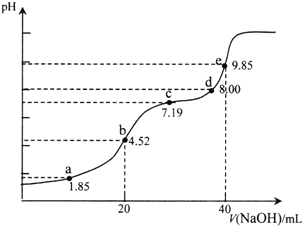
A. a点所得溶液中:2c(HSO3-)+c(SO32-)=0.1mol/L
B. b点所得溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
C. c点所得溶液中:c(Na+)>3c(HSO3-)
D. e点所得溶液中:c(Na+)> c(SO32-)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试完成下列问题:(提示:氢氧化钙的溶解度随温度升高而降低)

(1)实验中观察到的现象是______________________________________;
(2)产生上述现象的原因是______________________________________。
(3)写出有关反应的离子方程式____________________________________。
(4)由实验推知,MgCl2溶液和H2的总能量_____________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
(5)如将本题中“25℃石灰水饱和溶液”换成“20℃碳酸饮料”进行探究实验,实验(1)中观察到的另一现象是________________,其原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
B. 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C. 反应CO(g)+NO2(g) ![]() CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D. 对于反应2HI(g) ![]() H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于短周期的四种主族元素A、B、C、D,原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。E是自然界中含量最高的金属。根据你的推断完成下列问题:
(1)B元素的名称为_______,E的元素符号为_______。
(2)写出由上述元素形成的具有漂白作用的三种物质的化学式______,______,_____。
(3)用电子式表示C与D形成化合物的过程_______。
(4)写出E的最高价氧化物与强碱反应的离子方程式________。
(5)B、C两元素形成的原子个数比为1∶1的化合物中的化学键为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向某浓度的ZnCl2溶液中滴加NaOH稀溶液直到Zn2+完全沉淀(浓度低于10-5mol/L),溶液pH分别为6、7、8时Zn2+浓度如图所示,其中A点恰好开始产生沉淀,下列说法错误的是

A. C点时Zn2+尚未沉淀完全
B. B点时c(C1-)-c(Na+)=0.0012mol/L
C. 原ZnCl2溶液的物质的量浓度大于0.12mol/L
D. 常温下Zn(OH)2的溶度积为1.2×10-17
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Pt(NH3)4(NO2)Cl]CO3是一种铂的配合物,请回答下列相关问题。
(1) [Pt(NH3)4(NO2)Cl]CO3所含有的短周期元素中基态原子未成对电子数最多的是___________(填元素符号),与该元素同族的第四周期元素基态原子的最外层电子排布式是___________。
(2)CO32-的中心原子杂化形式是___________,空间构型是___________。
(3) [Pt(NH3)4(NO2)Cl]CO3中心原子的配位数是___________,与配体之一NO2-互为等电子体的单质分子化学式是___________。
(4)根据相互作用的分子种类不同可以把范德华力分为色散力、诱导力和取向力,其中取向力只存在于极性分子和极性分子之间,则在新制氯水中存在的取向力有___________种。
(5)如图是晶体铂的晶胞结构,则铂原子的配位数为___________,晶体铂的空间利用率为___________(用含“π”的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列七个反应:①煅烧石灰石制生石灰 ②燃烧蜂窝煤取暖 ③炸药爆炸 ④硫酸与氢氧化钾溶液反应 ⑤生石灰与水作用制熟石灰 ⑥食物腐败 ⑦碳与水蒸气反应制得水煤气。其中放热反应的一组是( )
A. ①⑦B. ①⑤⑦C. ②③④⑥D. ②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C都是金属,把A浸入B的硝酸盐溶液中,A的表面有B析出,B与C和稀硫酸组成原电池时,B为电池的负极。A、B、C三种金属的活动性顺序为( )
A. B>A>CB. A>C>B
C. A>B>CD. B>C>A
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com