
【题目】下列事实不能用勒夏特列原理解释的是
A. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
B. 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C. 反应CO(g)+NO2(g) ![]() CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D. 对于反应2HI(g) ![]() H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2 (g),达平衡后,缩小容器体积可使体系颜色变深
【答案】D
【解析】勒夏特列原理为:如果改变影响化学平衡的一个条件,平衡将向着能够减弱这种改变的方向移动,则A.溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,生成溴化银沉淀,平衡向正反应方向移动,溶液颜色变浅,A不符合题意;B.合成氨反应,N2(g)+3H2(g)
HBr+HBrO,当加入硝酸银溶液后,生成溴化银沉淀,平衡向正反应方向移动,溶液颜色变浅,A不符合题意;B.合成氨反应,N2(g)+3H2(g)![]() 2NH3(g),△H<0,为提高氨的产率,理论上应采取降低温度的措施,有利于平衡向正反应方向移动,B不符合题意;C.反应CO(g)+NO2(g)
2NH3(g),△H<0,为提高氨的产率,理论上应采取降低温度的措施,有利于平衡向正反应方向移动,B不符合题意;C.反应CO(g)+NO2(g)![]() CO2(g)+NO(g)ΔH<0,达平衡后,升高温度平衡逆向移动,二氧化氮浓度增大,颜色加深,能用勒夏特列原理解释,C不符合题意;D.两边气体计量数相等,压强改变平衡不移动,不能用勒夏特列原理解释,D符合题意,答案选D。
CO2(g)+NO(g)ΔH<0,达平衡后,升高温度平衡逆向移动,二氧化氮浓度增大,颜色加深,能用勒夏特列原理解释,C不符合题意;D.两边气体计量数相等,压强改变平衡不移动,不能用勒夏特列原理解释,D符合题意,答案选D。


科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c (NO)与温度T的关系如下图所示,则下列说法正确的是
CO2(g)+N2(g),平衡时c (NO)与温度T的关系如下图所示,则下列说法正确的是
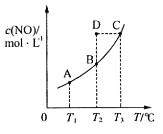
A. 该反应的△H>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C.在T2时,若反应体系处于状态D,则此时![]()
D.若状态B、C、D的压强分别为PB、PC 、PD ,则 PC=PD>PB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】符号3Px所代表的含义是:( )
A. Px轨道上有3个电子 B. 第三电子层Px轨道有3个伸展方向
C. Px电子云有3个伸展方向 D. 第三电子层沿x轴方向伸展的p轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5L某NaCl溶液中含有0.5molNa+ , 对该溶液的说法不正确的是( )
A.配制100mL该溶液需用5.85g NaCl
B.该溶液的物质的量浓度为1molL ﹣1
C.该溶液中含有58.5g NaCl
D.量取100mL该溶液,其中Na+的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5L某NaCl溶液中含有0.5molNa+ , 对该溶液的说法不正确的是( )
A.配制100mL该溶液需用5.85g NaCl
B.该溶液的物质的量浓度为1molL ﹣1
C.该溶液中含有58.5g NaCl
D.量取100mL该溶液,其中Na+的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物含量显得尤为重要。
Ⅰ.氮氧化物研究
(1)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g),下列各项能说明反应达到平衡状态的是____________。
2NO2(g),下列各项能说明反应达到平衡状态的是____________。
a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2molNO同时生成2 molNO2
(2)汽车内燃机工作时会引起N2和O2的反应:N2+ O2![]() 2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ O2(g)
2NO,是导致汽车尾气中含有NO的原因之一。在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g)+ O2(g)![]() 2NO(g)的△H____0(填“>”或“<”)。
2NO(g)的△H____0(填“>”或“<”)。

(3)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引发N2和O2反应,
其能量变化如图所示:
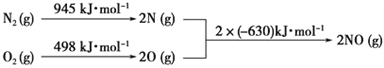
写出该反应的热化学方程式:________________________________。
Ⅱ.二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是坏境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(s)+O2(g)![]() 2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:
2SO3(g),某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图所示。根据图示回答下列问题:
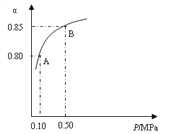
①将2.0 molSO2和1.0molO2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于__________。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为__________(阿伏加德罗常数的值用NA表示),放出的热量为___________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是
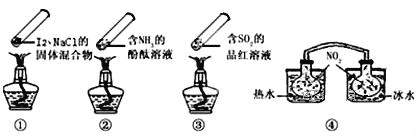
A. 加热时,①上部汇聚了固体碘,说明碘的热稳定性较差
B. 加热时,②、③中的溶液均变红,冷却后又都变为无色
C. ④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D. 四个“封管实验”中都有可逆反应发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用98%的浓硫酸( ![]() =1.84g/mL﹣1)配制成浓度为3.68mol/L﹣1的稀硫酸500mL.请按要求填空:
=1.84g/mL﹣1)配制成浓度为3.68mol/L﹣1的稀硫酸500mL.请按要求填空:
(1)所需浓硫酸的体积为mL
(2)请将下列操作按正确的序号填在横线上:
A用量筒量取浓硫酸 B反复颠倒摇匀 C用胶头滴管加水至刻度线 D洗净烧杯内壁和玻璃棒,并将洗液转至容量瓶 E稀释浓硫酸 F将溶液转入容量瓶 G向容量瓶中加入适量蒸馏水至距离刻度线1~2cm处
其操作正确顺序为 .
(3)使用容量瓶前需要先进行操作的是 ,
(4)若实验中出现下列现象对所配溶液有什么影响?(填偏高、偏低、无影响)
①浓硫酸溶解后未冷却至室温即进行定容 ,
②定容时俯视刻度线 ,
③配制前容量瓶内有水 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列有机反应类型的认识中,错误的是
A. ![]() ;取代反应
;取代反应
B. CH2=CH2 + Br2![]() CH2Br-CH2Br;加成反应
CH2Br-CH2Br;加成反应
C. 2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O;取代反应
2CH3CHO+2H2O;取代反应
D. CH3COOH + CH3CH2OH ![]() CH3COOCH2CH3+H2O;取代反应
CH3COOCH2CH3+H2O;取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com