
| A.a=b/2 | B.b=a+0.02 | C.a=b+0.02 | D. a=b+0.01 |
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加热盐酸溶液,溶液的pH减小 | B.随温度的升高,纯水的pH增大 |
| C.新制氯水经光照一段时间后,pH减小 | D.NaOH溶液久置于空气中,pH增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH =6的溶液一定呈酸性 |
| B.c(H+)水电离产生= c(OH-)水电离产生的溶液一定呈中性 |
| C.使石蕊试液显红色的溶液一定呈酸性 |
| D.强酸和强碱等物质的量混合后溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
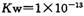 ,下列叙述正确的是
,下列叙述正确的是| A.700C时,向纯水中加人H3PO4后,水的Kw减小 |
B.700C的Na2CO3溶液中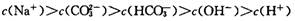 |
C.700C的H2S04溶液中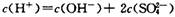 |
D.将室温下0.1 mol/L的NaOH溶液加热至700C时,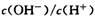 随之增大 随之增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊试液呈红色 |
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
| C.pH=2与pH=1的硝酸中c(H+)之比为10:1 |
D.向0.1 mol/L的氨水中加入少量醋酸铵固体,则溶液中 增大 增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在25℃时,AG = 10的溶液呈碱性 |
| B.在25℃时,若溶液呈中性,则pH =7,AG = 1 |
| C.在25℃时,溶液的pH与AG的换算公式为AG = 2(7-pH) |
| D.在25℃时,0.1 mo1·L—1 NaOH溶液AG = 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com