
| A.在25℃时,AG = 10的溶液呈碱性 |
| B.在25℃时,若溶液呈中性,则pH =7,AG = 1 |
| C.在25℃时,溶液的pH与AG的换算公式为AG = 2(7-pH) |
| D.在25℃时,0.1 mo1·L—1 NaOH溶液AG = 0 |
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源:不详 题型:单选题
 的绝对值均正确)
的绝对值均正确)| A.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g)△H="–1367.0" kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△H= +57.3kJ/mol(中和热) |
| C.S(s)+O2(g)=SO2(g)△H=–269.8kJ/mol(反应热) |
| D.2NO2=O2+2NO△H= +116.2kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a=b/2 | B.b=a+0.02 | C.a=b+0.02 | D. a=b+0.01 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(Na+)> c(HCO3-)> c(CO32-)> c(H+)> c(OH-) |
| B.c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+) |
| C.c(Na+)= c(HCO3-) + 2c(CO32-) + c(H2CO3 |
| D.c(Na+) + c(H+)= c(HCO3-) + 2c(CO32-) + c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将②溶液用蒸馏水稀释,使体积扩大10倍,所得溶液pH变为(a-1) |
| B.V1L③溶液和V2L④溶液混合,若混合后溶液pH=3,则V1:V2=11:9 |
| C.①与④两溶液等体积混合,混合液pH=7 |
| D.①与③两溶液的物质的量浓度相等 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 变化的判断中,错误的是
变化的判断中,错误的是| A.随着温度的升高,醋酸溶液的pH减小 |
| B.随着温度的升高,纯水的pH增大 |
| C.新制氯水经光照一段时间后,pH减小 |
| D.氢氧化钠溶液久置于空气中,pH减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
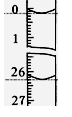
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000 mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 平均耗用盐酸 体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.15 | ①V=__________ |
| 第二次 | 25.00 | 0.56 | 30.30 | |
| 第三次 | 25.00 | 0.20 | 26.45 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com