
(10�֣���ش���������
��1����֪��25��ʱ��0.1 mol��L��1��HA��Һ��c(H+)/c(OH-)��1010��
��HA��________(�ǿ����ʡ���������ʡ�)��
���ڼ�ˮϡ��HA��Һ�Ĺ����У�����ˮ�������Ӷ���С����________(����ĸ)��
A��c(H+)/c(HA) B��c(HA)/ c (A-)
C��c(H��)��c(OH��)�ij˻� D��c(OH��)
����M��Һ��������HA��ҺV1 mL��pH = 12��NaOH��ҺV2 mL��ϳ�ַ�Ӧ���ã�������˵������ȷ����_______(����ĸ)��
A������ҺM�����ԣ�����ҺM��c(H+) + c(OH-) = 2.0��10-7 mol��L-1
B����V1 =V2 ������ҺM��pHһ������7
C������ҺM�����ԣ�V1һ������V2
D������ҺM�ʼ��ԣ�V1һ��С��V2
��2������֪��25�棬AgCl��Ksp = 1.8��10-10���ֽ�����AgCl�ֱ���룺��100 mL ����ˮ�У���100 mL 0.2mol��L-1 AgNO3��Һ�У���100 mL 0.1mol��L-1 AlCl3��Һ�У���100 mL 0.1mol��L-1�����У���ֽ������ͬ�¶���c(Ag+)�ɴ�С��˳���� ����������ӣ�
��3������2NO2(g) N2O4(g) ��H < 0��Ӧ�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ��������˵����ȷ���� ��
N2O4(g) ��H < 0��Ӧ�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ��������˵����ȷ���� ��

��A��C����ķ�Ӧ���ʣ�A>C
��A��C�����������ɫ��A�Cdz
��B��C����������ƽ������������B<C
����״̬B��״̬A�������ü��ȷ���
��1����������ʣ�2�֣� ��B��2�֣� ��A D��2�֣���2����>��>��>�ۣ�2�֣���3���ڣ��ܣ�2�֣�
��������
�����������1�������HA��ǿ�����0.1 mol��L��1��HA��Һ��c(H+)=0.1mol��L��1��c��OH-��=10-13mol��L��1����c(H+)/c(OH-)��1012������ c(H+)/c(OH-)��1010����HA��������ʡ� �ڼ�ˮϡ�ͣ�c(HA)�� c(H+)�� c (A-) �����С����ϡ����ƽ���������ƶ���c(H+)�� c (A-) ��С�Ľ�����c(H+)/c(HA)���� c(HA)/ c (A-)��С��c(H��)��c(OH��)�ij˻���ˮ�����ӻ������䣻���Լ�����������ǿ��c(OH��)����ѡB������Һ��������c(H+) =c(OH-) = 1.0��10-7 mol��L-1��A�ԣ���V1 =V2 �����������Һ�����ԣ�B�������Ũ�ȴ��Ũ��С������������С�����ҺҲ�������ԣ�C�����������Ũ�Ƚϴ���ҺҪ�Լ��ԣ��������Ҫ��D�ԣ�ѡA D����2����100 mL ����ˮ�У�c(Ag+)= Ksp 1/2= (1.8��10-10)1/2=1.3��10-5 mol��L��1����100 mL 0.2mol��L-1 AgNO3��Һ�У�c(Ag+)= 0.2mol��L-1����100 mL 0.1mol��L-1 AlCl3��Һ�У�c(Ag+)=1.8��10-10��0.3=6.0��10-10mol��L��1����100 mL 0.1mol��L-1�����У�c(Ag+)=1.8��10-10��0.1=1.8��10-9mol��L��1����c(Ag+)Ũ�ȴ�С˳��Ϊ����>��>��>�ۡ���3��A��C�����¶���ͬ��C���ѹǿ�ϴ�C��ķ�Ӧ���ʽϿ죬�ٴ���A��NO2����������ϴ�Ũ��Ҳ�ϴ�A�����ɫ����ڶԣ���B��C����NO2�����������ͬ��������Է�������Ҳ��ȣ��۴���״̬B��״̬A��Ҫ����NO2�������������ƽ���������ƶ���Ӧʱ���ȷ�Ӧ���������¶ȿ�ʹƽ���������ƶ����ܶ�ѡ�ڡ���
���㣺ǿ������ʵ��жϣ���Һ���ʱ������Ũ�ȴ�С�Ƚϡ��й�Ksp�ļ���ͻ�ѧƽ����ƶ���


 �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�����и߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
�����и���Һ�У��������ʵ���Ũ�ȹ�ϵ������ȷ����
A��0.1 mol/L��(NH4)2SO4��Һ�У�c(SO42��)>c(NH4+)>c(H��)��c(OH��)
B��0.1 mol/L��NaHCO3��Һ�У�c(Na��)��c(HCO3-)��c(H2CO3)��2c(CO32-)
C����0.2 mol/L NaA��Һ��0.1 mol/L��������������ü�����Һ�У�c(Na��)��c(H��)��c(A��)��c(Cl��)
D����25��100 mL NH4Cl��Һ�У�c(Cl��)��c(NH4+)��c(NH3��H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015���������и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���������У����ܵ��������ڵ���ʵ���
A������ B�����ڵ��Ȼ��� C���Ȼ������� D��пƬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���һѧ�ڻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ZnSO4��Һ�м���Na2S��Һʱ���õ���ɫ������Ȼ�����ɫ�����ϵμ�CuSO4��Һ�����ֳ�����Ϊ��ɫ��������˵������ȷ����
A����ɫ����ΪZnS������ɫ����ΪCuS
B�����ø�ԭ����ʵ��һ�ֳ���ת��Ϊ�����ܵij���
C���ù����ƻ���ZnS���ܽ�ƽ��
D����������˵��ZnS��KspС��CuS��Ksp
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�߶���һѧ�ڻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
������ʵ�У���˵��HNO2��������ʵ���
A����HNO2��Һ�����������飬�ƹ�ϰ�
B��HNO2�ǹ��ۻ�����
C��HNO2��Һ�����Ȼ��Ʒ�Ӧ
D�������£�0.1mol��L-1HNO2��Һ��pHΪ2.15
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ����и߶���ѧ�����ƻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�¶�ʱ����25mL 0.1mol/L NaOH��Һ����μ���0.2mol/L CH3COOH��Һ��������ͼ��ʾ���й�����Ũ�ȹ�ϵ�ıȽ���ȷ����
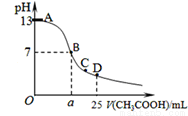
A����D�㣺c��CH3COO-��+c��CH3COOH��=2c��Na+��
B����C�㣺c��CH3COO-����c��Na+����c��OH-����c��H+��
C����B�㣬a��12.5������c��Na+��=c��CH3COO-��=c��OH-��=c��H+��
D����A��B����һ�㣬��Һ��һ������c��Na+����c��CH3COO-����c��OH-����c��H+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ����и߶���ѧ�����ƻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��2A��B  3C��4D��Ӧ�У���ʾ�÷�Ӧ����������
3C��4D��Ӧ�У���ʾ�÷�Ӧ����������
A��v��A���� 0.5 mol/��L���� B��v��B���� 0.3 mol/��L����
C��v��C���� 0.8 mol/��L���� D��v��D���� 1 mol/��L����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ������Сѧ�θĸ߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��25 ��ʱ��2C(s)��O2(g)��2CO(g) ��H1����222 kJ/mol
2H2(g)��O2(g)��2H2O(g) ��H2����484 kJ/mol
C(s)��O2(g)��CO2(g) ��H3����394 kJ/mol
��25 ��ʱ��CO(g)��H2O(g)��CO2(g)��H2(g)�ķ�Ӧ�� ��H4Ϊ
A����82 kJ/mol B����41 kJ/mol
C����312 kJ/mol D����82 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㶫ʡ�����и�һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ʣ�������CO2��Ӧ����������SiO2��Ӧ����
A��HF B��H2O C��CaO D��NaOH
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com