
【题目】己知:
(1)Al(OH)3的电离方程式:AlO2-+H++H2O![]() Al(OH)3
Al(OH)3![]() A13++3OH-
A13++3OH-
(2)无水AlCl3晶体的沸点:182.9℃,溶于水的电离方程式为:AlCl3=Al3++3Cl-
(3)PbSO4难溶于水,易溶于醋酸钠溶液,反应的化学方程式为:PbSO4+2CH3COONa=Na2SO4+(CH3COO)2Pb
则下列关于A1(OH)3、AlCl3和(CH3COO)2Pb的说法中正确的是( )
A.均为强电解质 B.均为弱电解质
C.均为离子化合物 D.均为共价化合物
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
①铝和铜具有良好的导电性,所以电工操作时,可以把铜线和铝线拧在一起
②汽车尾气中含有能污染空气的氮氧化物,主要是汽油燃烧不充分造成的
③从海水中提取物质都必须通过化学反应才能实现
④“辽宁舰”上用于舰载机降落拦阻索的特种钢缆属于新型无机非金属材料
⑤明矾可以用于净水,主要是由于Al3+水解生成的少量氢氧化铝胶体有净水作用
A.②③⑤ B.①②④ C.①③④⑤ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟用下图装置测定某粗锌样品中锌的质量分数。他们查阅资料后获知该粗锌样品中的其他成分不能与稀盐酸反应。请填写以下实验报告。
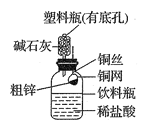
(1)实验目的: 。
(2)实验步骤:
①称取10.0g粗锌置于铜网中,按图示装置组装后,称得仪器和药品总质量为120.0g。
②将铜网插入足量的稀盐酸中,有关反应的化学方程式为 。
③反应完全后,称得装置总质量为119.8g,则粗锌中锌的质量分数为 。
(3)问题探究:(已知碱石灰是NaOH和CaO的混合物,常用于干燥、吸收气体)
①该实验若不用碱石灰,则所测得的粗锌中锌的质量分数将 (填“偏大”、“偏小”或“无影响”);
②若将粗锌换成某含有杂质的石灰石样品(杂质也不与稀盐酸反应),判断该实验方案能不能用于石灰石样品中CaCO3质量分数的测定,并说明理由____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:
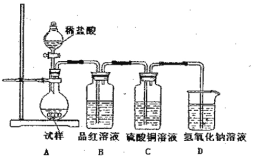
(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开能分解,且分解产物只有硫化钠和另种固体。如果加热温度低于字600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3-的物质的量浓度变化趋势为 ;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生生成黄色沉淀的离子方程式为 ;此时在B、C两装置中可能观察到的现象为 。
(3)在(2)中滴加定暈盐酸后,烧瓶内除Cl-外还存在另一种浓度较大的阴离子(X)。为检验该阴离子(X),先取固体试样溶于水配成溶液,然后按以下两种实验方案检验阴离子(X),认为合理的方案是 (填“甲”或“乙”),请说明另一种方案不合理的原因 。
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于液管中,先如稀HCl,再加BaCl2溶液,有白色淀淀生成,证明该离子存在。
(4)写出Na2SO3固体加热到600℃以上分解的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化工生产的叙述中,符合目前工业生产实际的是( )
A.石油工业中,采用干馏的方法把石油分成不同沸点范围的产品
B.硝酸工业中,为了加快氨氧化的速率,通常使用铁触媒作催化剂
C.纯碱工业中,氨碱法通过氨气和二氧化碳的循环利用,提高了原料的利用率
D.合成氨工业中,采用高压条件,增大合成氨反应的平衡常数,增大原料转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是( )
A.使用填埋法处理未经分类的生活垃圾
B.用K2FeO4代替Cl2处理饮用水,既有杀菌消毒作用,又有净水作用
C.大量使用薪柴为燃料,实现低碳生活
D.CO2、NO2或SO2的排放是形成酸雨的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用双线桥标出下列反应中电子转移的方向和数目,并填空。
(1)Cl2+SO2+2H2O=H2SO4+2HCl
氧化剂是__________;被氧化的物质是_____________
(2)3NO2+2H2O=2HNO3+NO
氧化产物是___________.氧化剂与还原剂的质量比为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A.1mol羟基与1mol氢氧根离子所含的电子数均为9NA
B.常温下,44g N2O和CO2组成的混合气体,所含原子数为3NA
C.0.1mol/L的NaClO溶液,含有的阴离子数为0.1NA
D.常温下,将1molFe投入过量浓硝酸中,转移的电子数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com