
【题目】为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:
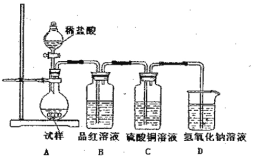
(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开能分解,且分解产物只有硫化钠和另种固体。如果加热温度低于字600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3-的物质的量浓度变化趋势为 ;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生生成黄色沉淀的离子方程式为 ;此时在B、C两装置中可能观察到的现象为 。
(3)在(2)中滴加定暈盐酸后,烧瓶内除Cl-外还存在另一种浓度较大的阴离子(X)。为检验该阴离子(X),先取固体试样溶于水配成溶液,然后按以下两种实验方案检验阴离子(X),认为合理的方案是 (填“甲”或“乙”),请说明另一种方案不合理的原因 。
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于液管中,先如稀HCl,再加BaCl2溶液,有白色淀淀生成,证明该离子存在。
(4)写出Na2SO3固体加热到600℃以上分解的化学方程式 。
【答案】(1)先逐渐增大,后逐渐减小;(2)2S2-+SO32-+6H+=3S↓+3H2O;B中品红溶液褪色,C中无明显变化。(或B中无明显变化,C中产生黑色沉淀);(3)乙;(2分)甲中先加入具有强氧化性的稀HNO3,它能将SO32-氧化成SO42-,不能判定是否生成SO42-;(4)4Na2SO3![]() Na2S+3Na2SO4。
Na2S+3Na2SO4。
【解析】
试题分析:(1)温度低于600℃,Na2SO3不分解,因此加入盐酸,发生Na2SO3+HCl=NaHSO3+NaCl,NaHSO3+HCl=NaCl+SO2↑+H2O,HSO3-的浓度先变大,后变小;(2)出现淡黄色沉淀,说明生成S单质,加热700℃,Na2SO3部分分解,分解成硫化钠和硫酸钠,生成S的离子反应方程式为2S2-+SO32-+6H+=3S↓+3H2O,硫化钠可能过量,生成H2S气体,不能使品红溶液褪色,但和硫酸铜发生CuSO4+H2S=CuS↓+H2SO4,品红溶液不变色,硫酸铜出现黑色沉淀,也有可能是亚硫酸钠过量,产生SO2,SO2能使品红溶液褪色,硫酸铜不变浑浊;(3)方案甲,稀硝酸具有强氧化性,能把SO32-氧化成SO42-,加入BaCl2溶液出现白色沉淀BaSO4,SO32-干扰SO42-的判断,故错误;方案乙先加入稀盐酸,排除离子的干扰,如Ag+、SO32-等,再加入BaCl2溶液,出现白色沉淀,说明溶液中含有SO42-,方案乙合理;(4)根据上述分析,反应方程式为:4Na2SO3![]() Na2S+3Na2SO4。
Na2S+3Na2SO4。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3的反应研究NH3的性质与分子组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1)仪器a的名称为 ;仪器b中的试剂不能为下列中的 (填字母)
A.氧化钙 B.碱石灰 C.石灰石 D.生石灰

(2)装置B的作用是
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管收集到无色无味的气体,上述现象证明了NH3具有 性,写出装置C中发生反应的化学方程式
(4)E装置中浓硫酸的作用 (写出一条即可)
(5)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为 (用含m、n字母的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中,不正确的是( )
A.液化石油气和天然气的主要成分都是甲院
B.苯、乙醇和乙酸都能发生取代反应
C.油脂在碱的催化作用下可发生水解,工业上利用该反应生产肥皂
D.煤的气化是化学变化,石油分馏是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如右图所示,对该反应的推断合理的是( )
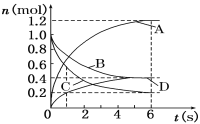
A.该反应的化学方程式为3B+4D ![]() 6A+2C
6A+2C
B.反应进行到1 s时,v(A)=v(D)
C.反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D.反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠溶液与稀硫酸反应的化学方程式为: Na2S203+H2S04=Na2S04+S02+S↓+H20,下列各组实验中最先出现浑浊的是( )
实验 | 反应温度℃ | Na2SO4 | Na2S2O3 溶液 | 稀 H2SO4 | H2O | |
V/mL | c/ (moL-L-1) | V/mL | d (moL-L-1) | V/mL | ||
A | 25 | 5 — | 0.1 | 10 | 0.1 | 5 |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:
(1)Al(OH)3的电离方程式:AlO2-+H++H2O![]() Al(OH)3
Al(OH)3![]() A13++3OH-
A13++3OH-
(2)无水AlCl3晶体的沸点:182.9℃,溶于水的电离方程式为:AlCl3=Al3++3Cl-
(3)PbSO4难溶于水,易溶于醋酸钠溶液,反应的化学方程式为:PbSO4+2CH3COONa=Na2SO4+(CH3COO)2Pb
则下列关于A1(OH)3、AlCl3和(CH3COO)2Pb的说法中正确的是( )
A.均为强电解质 B.均为弱电解质
C.均为离子化合物 D.均为共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.04 g铜镁合金完全溶解于100 mL 14.0 mol/L的浓硝酸中,得到NO2和N2O4的混合气体2240 mL(标准状况),向反应后的溶液中加入2.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到5.08 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2∶1
B.被还原的硝酸的物质的量是0.12 mol
C.得到5.08 g沉淀时,加入NaOH溶液的体积是700 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)质量比为51:32:34的NH3、CH4、H2S,其物质的量之比为 ,它们所含氢原子数之比为 ,所含质子数之比为 。
(2)在150℃,mgNH4HCO3固体完全分解生成NH3、CO2、H2O,若所得混合气体是H2密度的d倍,则用含m、d的代数式表示混合气体的物质的量为 ;用含d的代数式表示NH4HCO3的摩尔质量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com