
【题目】3.04 g铜镁合金完全溶解于100 mL 14.0 mol/L的浓硝酸中,得到NO2和N2O4的混合气体2240 mL(标准状况),向反应后的溶液中加入2.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到5.08 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2∶1
B.被还原的硝酸的物质的量是0.12 mol
C.得到5.08 g沉淀时,加入NaOH溶液的体积是700 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
【答案】C
【解析】
试题分析:金属离子全部沉淀时,得到5.08g沉淀为氢氧化铜、氢氧化镁,则沉淀中氢氧根离子的质量为:5.08g-3.04g=2.04g,氢氧根离子的物质的量为![]() =0.12mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,设铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:2x+2y=0.12、64x+24y=3.04,解得:x=0.04,y=0.02,故合金中Cu与Mg的物质的量之比是0.04mol:0.02mol=2:1,故A正确;根据电子守恒,设被还原的硝酸的物质的量xmol, x=2×0.06,x=0.12mol,故B正确;根据元素守恒,当金属离子全部沉淀时,溶液中的溶质全是硝酸钠,n(NaNO3)= 0.1L× 14.0 mol/L-0.12mol =1.28mol,所以需要氢氧化钠的物质的量是1.28mol,加入NaOH溶液的体积是1.28mol ÷2 mol/L =0.64L=640 mL,故C错误;
=0.12mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,设铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:2x+2y=0.12、64x+24y=3.04,解得:x=0.04,y=0.02,故合金中Cu与Mg的物质的量之比是0.04mol:0.02mol=2:1,故A正确;根据电子守恒,设被还原的硝酸的物质的量xmol, x=2×0.06,x=0.12mol,故B正确;根据元素守恒,当金属离子全部沉淀时,溶液中的溶质全是硝酸钠,n(NaNO3)= 0.1L× 14.0 mol/L-0.12mol =1.28mol,所以需要氢氧化钠的物质的量是1.28mol,加入NaOH溶液的体积是1.28mol ÷2 mol/L =0.64L=640 mL,故C错误;
D.NO2和N2O4混合气体的物质的量为:![]() =0.1mol,设二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.1-a)mol,根据电子转移守恒可知,a×1+(0.1-a)×2×1=0.12,解得a=0.08,NO2的体积分数为80%,故D正确。
=0.1mol,设二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.1-a)mol,根据电子转移守恒可知,a×1+(0.1-a)×2×1=0.12,解得a=0.08,NO2的体积分数为80%,故D正确。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验及显色结果的叙述,错误的是
A.水浴加热条件下,麦芽糖与斐林试剂发生反应生成砖红色沉淀
B.蛋白质溶液遇双缩脲试剂变紫色
C.人的口腔上皮细胞经健那绿染色后,可以看到呈蓝绿色的线粒体
D.常温条件下,脱氧核糖核酸与吡罗红作用呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:
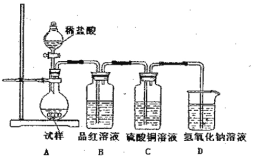
(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开能分解,且分解产物只有硫化钠和另种固体。如果加热温度低于字600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3-的物质的量浓度变化趋势为 ;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生生成黄色沉淀的离子方程式为 ;此时在B、C两装置中可能观察到的现象为 。
(3)在(2)中滴加定暈盐酸后,烧瓶内除Cl-外还存在另一种浓度较大的阴离子(X)。为检验该阴离子(X),先取固体试样溶于水配成溶液,然后按以下两种实验方案检验阴离子(X),认为合理的方案是 (填“甲”或“乙”),请说明另一种方案不合理的原因 。
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于液管中,先如稀HCl,再加BaCl2溶液,有白色淀淀生成,证明该离子存在。
(4)写出Na2SO3固体加热到600℃以上分解的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化工生产的叙述中,符合目前工业生产实际的是( )
A.石油工业中,采用干馏的方法把石油分成不同沸点范围的产品
B.硝酸工业中,为了加快氨氧化的速率,通常使用铁触媒作催化剂
C.纯碱工业中,氨碱法通过氨气和二氧化碳的循环利用,提高了原料的利用率
D.合成氨工业中,采用高压条件,增大合成氨反应的平衡常数,增大原料转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是( )
A.使用填埋法处理未经分类的生活垃圾
B.用K2FeO4代替Cl2处理饮用水,既有杀菌消毒作用,又有净水作用
C.大量使用薪柴为燃料,实现低碳生活
D.CO2、NO2或SO2的排放是形成酸雨的主要原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关四位同学进行物质鉴定实验的叙述中正确的是
A. 张同学直接用碘液来检测苹果汁中的葡萄糖
B. 李同学用苏丹Ⅳ染液鉴定金龙鱼调和油中的脂昉
C. 王同学用西瓜汁代替梨汁进行还原糖鉴定实验
D. 赵同学用甲基绿鉴定蓝藻细胞核中的DNA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用双线桥标出下列反应中电子转移的方向和数目,并填空。
(1)Cl2+SO2+2H2O=H2SO4+2HCl
氧化剂是__________;被氧化的物质是_____________
(2)3NO2+2H2O=2HNO3+NO
氧化产物是___________.氧化剂与还原剂的质量比为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应能量的说法正确的是( )
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s);△H =-216kJ/mol,E反应物>E生成物
B.CaCO3(s)=CaO(s)+CO2(g);△H =+178.5kJ/mol,E反应物>E生成物
C.HI(g) ![]() 1/2H2(g)+ 1/2I2(s);△H = —26.5kJ/mol,由此可知1mol HI在密闭容器中分解后可以放出26.5kJ的能量
1/2H2(g)+ 1/2I2(s);△H = —26.5kJ/mol,由此可知1mol HI在密闭容器中分解后可以放出26.5kJ的能量
D.H+(aq)+OH-(aq)=H2O(l);△H = —57.3kJ/mol,含1molNaOH水溶液与含0.5mol H2SO4的浓硫酸混合后放热57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在周期表中1-36号之间的W、X、Y、Z、Q六种元素,它们的原子序数依次增大,已知W与其余五种元素既不同周期也不同主族,X原子的L层p轨道中有2个电子,Y元素原子的最外层有3个自旋方向相同的未成对电子,Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子,Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态。
(1)按电子排布,Q元素在周期表中属 区。
(2)第一电离能Y Z,电负性Y Z(填“>”“<”或“=”)。
(3)W与Z形成的常见化合物有W2Z、W2Z2,W与Y能形成多种二元化合物,如YW3、Y2W4、Y3W5、Y4W6……,W2Z分子中Z原子的杂化类型为 ,YW3分子的立体构型为 ,YW3极易溶于W2Z的主要原因有 。
(4)若向含有Q2+的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有深蓝色晶体析出,该晶体阳离子中含有的化学键有 。
(5)Q+与Y3-形成的晶胞结构如图所示。阴、阳离子间的核间距为a pm,阿伏伽德罗常数用NA表示,则晶体的密度为 g/cm3.

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com