
【题目】(1)质量比为51:32:34的NH3、CH4、H2S,其物质的量之比为 ,它们所含氢原子数之比为 ,所含质子数之比为 。
(2)在150℃,mgNH4HCO3固体完全分解生成NH3、CO2、H2O,若所得混合气体是H2密度的d倍,则用含m、d的代数式表示混合气体的物质的量为 ;用含d的代数式表示NH4HCO3的摩尔质量为 。
科目:高中化学 来源: 题型:
【题目】为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:
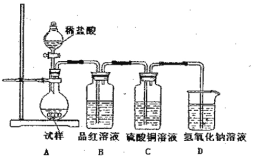
(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开能分解,且分解产物只有硫化钠和另种固体。如果加热温度低于字600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3-的物质的量浓度变化趋势为 ;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生生成黄色沉淀的离子方程式为 ;此时在B、C两装置中可能观察到的现象为 。
(3)在(2)中滴加定暈盐酸后,烧瓶内除Cl-外还存在另一种浓度较大的阴离子(X)。为检验该阴离子(X),先取固体试样溶于水配成溶液,然后按以下两种实验方案检验阴离子(X),认为合理的方案是 (填“甲”或“乙”),请说明另一种方案不合理的原因 。
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于液管中,先如稀HCl,再加BaCl2溶液,有白色淀淀生成,证明该离子存在。
(4)写出Na2SO3固体加热到600℃以上分解的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用双线桥标出下列反应中电子转移的方向和数目,并填空。
(1)Cl2+SO2+2H2O=H2SO4+2HCl
氧化剂是__________;被氧化的物质是_____________
(2)3NO2+2H2O=2HNO3+NO
氧化产物是___________.氧化剂与还原剂的质量比为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应能量的说法正确的是( )
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s);△H =-216kJ/mol,E反应物>E生成物
B.CaCO3(s)=CaO(s)+CO2(g);△H =+178.5kJ/mol,E反应物>E生成物
C.HI(g) ![]() 1/2H2(g)+ 1/2I2(s);△H = —26.5kJ/mol,由此可知1mol HI在密闭容器中分解后可以放出26.5kJ的能量
1/2H2(g)+ 1/2I2(s);△H = —26.5kJ/mol,由此可知1mol HI在密闭容器中分解后可以放出26.5kJ的能量
D.H+(aq)+OH-(aq)=H2O(l);△H = —57.3kJ/mol,含1molNaOH水溶液与含0.5mol H2SO4的浓硫酸混合后放热57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室制取CO2气体的过程中,不慎用到了浓盐酸,导致制得的CO2气体中混有HCl气体,他们设计了如下除去HCl气体并探究CO2与过氧化钠(Na2O2)反应的实验。【已知:2H2O + 2Na2O2 = 4NaOH + O2↑】请回答下列问题: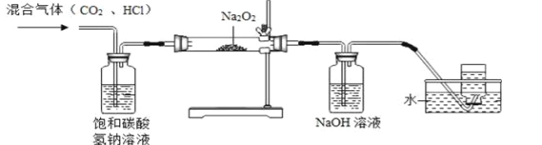
A B C D
(1)装置A的作用是: ;
(2)为确定反应后装置B硬质玻璃管中固体的成分,小组同学取适量固体于试管中,加入足量的蒸馏水溶解,形成溶液M,无气泡产生,则该固体中不含 ,该小组同学继续进行探究。
【提出问题】反应后硬质玻璃管中固体的成分是什么?
【做出猜想】猜想一:Na2CO3 猜想二:NaOH 猜想三:Na2CO3和NaOH,经过讨论,大家一致认为猜想二不合理,理由是: (用化学方程式表示)。
【实验验证】小组同学取上述形成的溶液M于试管中,向其中加入过量的 溶液,若产生白色沉淀,过滤,向滤液中滴加几滴酚酞试液,溶液变红,则证明猜想三成立。
【交流反思】小组中有同学认为,将上述滤液中滴加的酚酞试液换成硝酸铜溶液,也能得出同样的结论,你认为该同学的观点 (填“正确”或“错误”),理由是: (用化学方程式表示)。
【拓展延伸】在盛有氯化铵浓溶液的试管中,加入足量的过氧化钠(Na2O2)固体,有气泡产生, 试管口湿润的红色石蕊试纸变蓝,产生的气体是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A.1mol羟基与1mol氢氧根离子所含的电子数均为9NA
B.常温下,44g N2O和CO2组成的混合气体,所含原子数为3NA
C.0.1mol/L的NaClO溶液,含有的阴离子数为0.1NA
D.常温下,将1molFe投入过量浓硝酸中,转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在周期表中1-36号之间的W、X、Y、Z、Q六种元素,它们的原子序数依次增大,已知W与其余五种元素既不同周期也不同主族,X原子的L层p轨道中有2个电子,Y元素原子的最外层有3个自旋方向相同的未成对电子,Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子,Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态。
(1)按电子排布,Q元素在周期表中属 区。
(2)第一电离能Y Z,电负性Y Z(填“>”“<”或“=”)。
(3)W与Z形成的常见化合物有W2Z、W2Z2,W与Y能形成多种二元化合物,如YW3、Y2W4、Y3W5、Y4W6……,W2Z分子中Z原子的杂化类型为 ,YW3分子的立体构型为 ,YW3极易溶于W2Z的主要原因有 。
(4)若向含有Q2+的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有深蓝色晶体析出,该晶体阳离子中含有的化学键有 。
(5)Q+与Y3-形成的晶胞结构如图所示。阴、阳离子间的核间距为a pm,阿伏伽德罗常数用NA表示,则晶体的密度为 g/cm3.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的浓度的说法正确的是
A.将5.85 g NaCl固体溶于1 L水中可配成0.1mol/L的NaCl 溶液
B.500 ml 0.5mol/L 的NaOH溶液含NaOH分子0.25 mol
C.把200mL 3mol/L的BaCl2溶液跟100mL 3mol/L的KCl溶液混合后,溶液中的c(Cl-)仍然是3mol/L(忽略混合后体积变化)
D.把100g 20%的NaCl溶液跟100g H2O混合后,NaCl溶液的质量分数是10%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com