
【题目】用无机矿物资源生产部分材料,其生产流程如图.下列有关说法不正确的是( ) 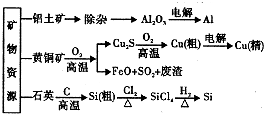
A.Al2O3、SiCl4均为共价化合物
B.生产过程中均涉及氧化还原反应
C.石英可用于制光导纤维,晶体Si常用做半导体材料
D.黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用于冶炼铁
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.17g氨气所含电子数目为10NA
B.32g氧气所含原子数目为NA
C.在25℃,压强为1.01×105Pa时,11.2L氮气所含的原子数目为NA
D.32g氧气与44g二氧化碳的体积一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校课外活动小组为了探讨铜与硝酸的反应设计了如下实验。
(1)甲同学欲探究铜与稀硝酸反应产生的气体主要是NO,设计装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是含有一半空气的注射器。
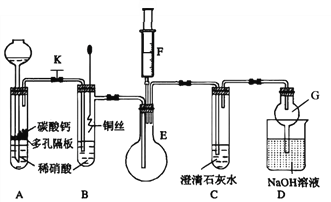
请回答有关问题:
①装置A中进行反应时打开止水夹K,当装置C中_________时,关闭止水夹K,试分析这样操作的目的是________,A中反应的离子方程式为______________。
②在完成①中的“操作”后,将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是__________________,B中反应的离子方程式为____________________。
③为进一步证明产物是NO,将注射器F中的空气推入E中,看到的现象是_________________。
④装置G的作用是_____________________。
(2)同学们发现铜与稀、浓硝酸反应所得溶液的颜色不同,并记录如下:
将1 g细铜丝放入盛有10 mL的1 mol·L-1 HNO3溶液的试管中加热 | 铜丝表面有无色气体逸出,溶液变为天蓝色 |
将1 g细铜丝放入盛有10 mL的14 mol·L-1HNO3溶液的试管中 | 产生大量红棕色气体,溶液变为绿色,绿色由深到浅,未见到蓝色 |
有同学认为是铜与浓硝酸反应的溶液中溶解了生成的气体,也有同学认为是溶液中剩余硝酸浓度较大所致,同学们分别设计了以下4个实验来判断该看法是否正确,以下方案中可行的是(选填序号字母)____________。
a. 向上述绿色溶液中通入氮气,观察颜色变化
b. 加水稀释上述绿色溶液,观察颜色变化
c. 向饱和的硝酸铜溶液中不断滴加14 mol·L-1HNO3溶液
d. 向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出明矾[KAl(SO4)212H2O]在水中的电离方程式______________________,明矾净水的原因是因为它与水反应产生_________。
(2)溶液的导电能力大小主要是由离子浓度大小决定的,利用“液体导电性的实验装置”(如右图所示)作下列实验,灯泡能出现由亮—暗—熄灭—亮现象的是______________
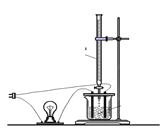
A.向BaCl2溶液中滴入稀H2SO4
B.向Ba(OH)2溶液中滴入稀H2SO4
C.向NaOH溶液中滴入盐酸
写出所选项的离子反应方程式________________________________
(3)Mn2+、Bi3+、BiO3-、MnO4-、H+、H2O组成的一个氧化还原反应体系中,发生BiO3-→Bi3+的反应过程。该反应中,被氧化的元素是_______,氧化剂是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学对氯气与铁的反应及产物进行了如下探究:
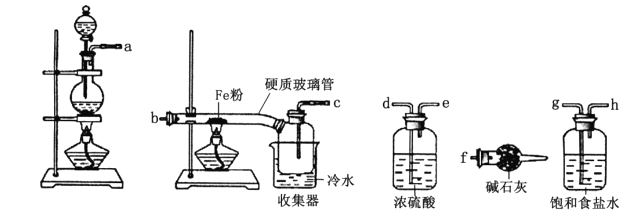
(1)装置的连接顺序为a→_____→______→_____→_____→b→c→f。_____________
(2)硬质玻璃管中可观察到的现象是______________;硬质玻璃管与收集器之间没有用导管连接,这样做的优点是_____________________。
(3)反应一段时间,熄灭酒精灯,冷却后,将收集器及硬质玻璃管中的物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
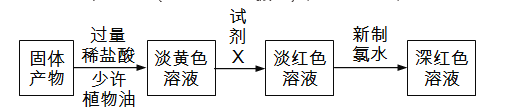
试剂X中溶质的化学式为_____________;有同学分析淡黄色溶液中含有Fe2+,你认为_____(填“合理”或“不合理”);固体产物的成分可能为_____(填字母)。
A.Fe和FeCl3 B.FeCl2和FeCl3 C.Fe、FeCl2和FeCl3 D.Fe和FeCl2
(4)加入少许植物油的作用是____________,加入新制氯水后溶液红色加深的原因:___________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列原电池对应的电极反应式正确的是( )
A.硫酸铅蓄电池的负极:Pb﹣2e﹣═Pb2+
B.锌银纽扣电池的正极:Ag2O+2e﹣+H2O═2AgOH
C.碱性锌锰电池的负极:Zn﹣2e﹣+2OH﹣═Zn(OH)2
D.氢氧碱性燃料电池的正极:2H2O+4e﹣═O2+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能,下列有关叙述正确的是( )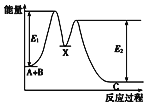
A.E2表示反应X→C的活化能
B.X是反应A+B→C的催化剂
C.反应A+B→C的△H<0
D.加入催化剂可改变反应A+B→C的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地壳中下列各元素所占质量分数从大到小的顺序是( )
A.Al、Fe、Si、OB.O、Si、Al、Fe
C.Fe、Al、Si、OD.Si、O、Fe、Al
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com