
【题目】下列原电池对应的电极反应式正确的是( )
A.硫酸铅蓄电池的负极:Pb﹣2e﹣═Pb2+
B.锌银纽扣电池的正极:Ag2O+2e﹣+H2O═2AgOH
C.碱性锌锰电池的负极:Zn﹣2e﹣+2OH﹣═Zn(OH)2
D.氢氧碱性燃料电池的正极:2H2O+4e﹣═O2+4H+
【答案】C
【解析】解:A、铅蓄电池是硫酸做电解质溶液,负极上是铅板放电生成PbSO4 , 故负极反应为:Pb﹣2e﹣+SO ![]() ═PbSO4 , 故A错误; B、锌银纽扣电池的正极是Ag2O放电,Ag2O+2e﹣+H2O═2Ag+2OH﹣ , 故B错误;
═PbSO4 , 故A错误; B、锌银纽扣电池的正极是Ag2O放电,Ag2O+2e﹣+H2O═2Ag+2OH﹣ , 故B错误;
C、碱性锌锰电池的负极是锌放电,由于是碱性电池,故负极反应为:Zn﹣2e﹣+2OH﹣═Zn(OH)2 , 故C正确;
D、碱性氢氧燃料电池的正极上是氧气放电,即氧气得电子,由于是碱性氢氧燃料电池,故正极反应为:O2+4e﹣+2H2O=4OH﹣ , 故D错误.
故选C.
A、铅蓄电池是硫酸做电解质溶液,负极上是铅板放电;
B、锌银纽扣电池的正极是Ag2O;
C、碱性锌锰电池的负极是锌;
D、碱性氢氧燃料电池的正极上是氧气放电.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组中的离子在强酸性水溶液里能大量共存的是
A. Ba2+、Na+、CO32-、NO3- B. K+、 CH3COO-、I-、Fe3+
C. Cu2+、Fe2+、SO42-、Cl- D. K+、Cl-、NO3-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关Na2CO3和NaHCO3的叙述中正确的是( )
A. 相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同
B. Na2CO3比NaHCO3热稳定性强
C. Na2CO3和NaHCO3均可与澄清石灰水反应
D. Na2CO3和NaHCO3均不可与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶无色澄清的溶液,可能由以下离子中的几种组成:Na+、K+、NH4+、Fe2+、SO42-、I-、CO32-、Cl-、SO32-、MnO4-,请根据以下实验步骤及现象回答问题:
步骤一:取适量待测液,加入NaOH溶液并加热,得到溶液A,并产生刺激性气味的气体
步骤二:向溶液A加入足量稀盐酸和BaCl2溶液,得到溶液B、白色沉淀和有刺激性气味的气体
步骤三:往B溶液中通入适量Cl2,得到黄褐色溶液C
(1)下列有关该溶液说法正确的是__________。
A. 一定存在SO42-、I-、NH4+、SO32-
B. 一定不存在Fe2+、CO32-、MnO4-
C. 可能存在CO32-、Cl-、Na+、K+
D. 可用AgNO3溶液确认原溶液中是否存在Cl-
(2)步骤三得到黄褐色溶液的离子方程式是____________。
(3)若向原溶液中先加入足量的盐酸,再加入足量的________(填化学式)并加热,通过现象也能得出步骤一、二相同的结论。
(4)对于溶液中还可能存在的阳离子,确认其存在的实验方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用无机矿物资源生产部分材料,其生产流程如图.下列有关说法不正确的是( ) 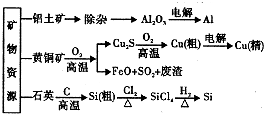
A.Al2O3、SiCl4均为共价化合物
B.生产过程中均涉及氧化还原反应
C.石英可用于制光导纤维,晶体Si常用做半导体材料
D.黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用于冶炼铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列题目
(1)现有以下物质 ① 酒精 ②盐酸 ③熔融KCl ④KOH固体 ⑤蔗糖 ⑥铜 ⑦稀H2SO4溶液
以上物质中属于电解质的是(填序号)________________
(2)同温同压下,同体积的CO2和CO,它们的分子数之比为____________ ,密度之比为_____________。
(3)向沸水中逐滴滴加1mol·L-1FeCl3溶液,至液体呈透明的红褐色,形成该分散系的微粒直径的范围是___________________。
(4)下列物质:①Cl2;②Na2CO3;③NaHCO3;④K—Na合金;⑤Na。
广泛用于玻璃、造纸的是______________(填编号,下同)
可用作原子反应堆的导热剂的是________________________。
(5)氯水具有多种性质,根据新制氯水分别与如图五种物质发生的反应填空(氯水足量):

上述反应中发生了氧化还原反应的是:________(填“a”、“b”、“c”或“e”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产和生活中有广泛的应用.
(1)铁元素在元素周期表中的位置为 .
(2)等物质的量的铁分别与足量的盐酸、水蒸气在一定条件下反应,产生相同条件下的气体体积比为 ,铁在高温条件下与水蒸气反应的化学方程式为 .
(3)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图: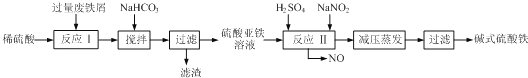
已知:常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe3+ | Fe2+ | Al3+ |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
①加入少量NaHCO3的目的是调节pH,应控制pH的范围为 .
②碱式硫酸铁溶于水后产生的[Fe(OH)2+]离子,可部分水解生成聚合离子[Fe2(OH)42+].该水解反应的离子方程式为 .
(4)高铁酸钾(K2FeO4)也是常用的水处理剂.它的制备方法有多种.
①熔融法又称为过氧化钠氧化法.先在高温熔融的条件下制备高铁酸钠:Fe+3Na2O2=Na2FeO4+2Na2O,再将高铁酸钠加入到氢氧化钾溶液里,发生反应:2KOH+Na2FeO4=K2FeO4+2NaOH,请根据复分解反应原理分析该反应发生的原因: .
②电解法制备高铁酸钾.铁和石墨分别做两个电极的电极材料,氢氧化钠溶液做电解液实现电解制备.阴极的电极材料为 , 写出阳极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.1 mol H2O的质量为18g·mol-1
B.标准状况下,1 mol任何物质体积均为22.4L
C.3.01×1023个SO2分子的质量为32g
D.CH4的摩尔质量为16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如图所示.R原子最外层电子数是电子层数的2倍.Y与Z能形成Z2Y、Z2Y2型离子化合物.Z与T形成的化合物Z2T能破坏水的电离平衡.下列推断正确的是( )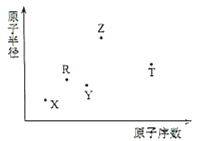
A.原子半径和离子半径均满足:Y<Z
B.氢化物的沸点不一定是:Y>R
C.最高价氧化物对应水化物的酸性:T<R
D.由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com