
����Ŀ�������仯�������������������й㷺��Ӧ�ã�
��1����Ԫ����Ԫ�����ڱ��е�λ��Ϊ ��
��2�������ʵ��������ֱ������������ᡢˮ������һ�������·�Ӧ��������ͬ�����µ����������Ϊ �����ڸ�����������ˮ������Ӧ�Ļ�ѧ����ʽΪ ��
��3����ʽ������[Fe��OH��SO4]��һ��������ˮ����������Ч����������ҽҩ��Ҳ���������������������Ѫ����ҵ�����÷���м�����������������������ȣ�������ʽ�������Ĺ���������ͼ��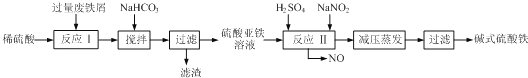
��֪�������£�����������������������ʽ����ʱ��Һ��pH���±���
������ | Fe3+ | Fe2+ | Al3+ |
��ʼ���� | 2.3 | 7.5 | 3.4 |
��ȫ���� | 3.2 | 9.7 | 4.4 |
�ټ�������NaHCO3��Ŀ���ǵ���pH��Ӧ����pH�ķ�ΧΪ ��
�ڼ�ʽ����������ˮ�������[Fe��OH��2+]���ӣ��ɲ���ˮ�����ɾۺ�����[Fe2��OH��42+]����ˮ�ⷴӦ�����ӷ���ʽΪ�� ��
��4��������أ�K2FeO4��Ҳ�dz��õ�ˮ�������������Ʊ������ж��֣�
�����ڷ��ֳ�Ϊ�������������������ڸ������ڵ��������Ʊ��������ƣ�Fe+3Na2O2=Na2FeO4+2Na2O���ٽ��������Ƽ��뵽����������Һ�������Ӧ��2KOH+Na2FeO4=K2FeO4+2NaOH������ݸ��ֽⷴӦԭ�������÷�Ӧ������ԭ�� ��
�ڵ�ⷨ�Ʊ�������أ�����ʯī�ֱ��������缫�ĵ缫���ϣ�����������Һ�����Һʵ�ֵ���Ʊ��������ĵ缫����Ϊ �� д�������ĵ缫��ӦʽΪ�� ��
���𰸡��������ڢ��壻3��4��3Fe+4H2O��g�� ![]() Fe3O4+4H2��4.4��7.5��2[Fe��OH��]2++2H2O?[Fe2��OH��4]2++2H+��K2FeO4�ܽ��С���������壬�ٽ���Ӧ���У�ʯī��Fe��6e��+8OH��=FeO42��+4H2O
Fe3O4+4H2��4.4��7.5��2[Fe��OH��]2++2H2O?[Fe2��OH��4]2++2H+��K2FeO4�ܽ��С���������壬�ٽ���Ӧ���У�ʯī��Fe��6e��+8OH��=FeO42��+4H2O
����������1������26��Ԫ�أ���Ԫ�����ڱ��е�λ��Ϊ�������ڢ��壬���Դ��ǣ��������ڢ��壻
��2����Fe�����ʵ���Ϊ1mol����
Fe+2HCl=FeCl2+H2��
1mol 1mol
3Fe+4H2O��g��![]() Fe3O4+4H2
Fe3O4+4H2
1mol ![]() mol��
mol��
��ͬ���������֮�ȵ������ʵ���֮�ȣ�������Ӧ�������������֮��Ϊ1mol��![]() mol=3��4�����Դ��ǣ�3��4��3Fe+4H2O��g��
mol=3��4�����Դ��ǣ�3��4��3Fe+4H2O��g�� ![]() Fe3O4+4H2��
Fe3O4+4H2��
��3�����Ʊ�����������Ӧ�����������룬Ӧ������ҺpH����Al��OH��3 �� Ҫ��������ӦFe��OH��2����������pH��4.4��7.5֮�䣬
���Դ��ǣ�4.4��7.5��
��[Fe��OH��]2+���ӣ��ɲ���ˮ������[Fe2��OH��4]2+�ۺ����ӣ����ݵ���غ�������غ��д����Ӧ�����ӷ���ʽΪ2[Fe��OH��]2++2H2O[Fe2��OH��4]2++2H+ ��
���Դ��ǣ�2[Fe��OH��]2++2H2O[Fe2��OH��4]2++2H+��
��4���ٸ��ֽⷴӦ�����������ɳ������������������ʣ���ΪK2FeO4�ܽ��С���������壬�ٽ���Ӧ���У����Դ��ǣ�K2FeO4�ܽ��С���������壬�ٽ���Ӧ���У���������������Ӧ������������������ʯī����ת��ΪFeO42�� �� ���Ե缫��ӦʽΪ��Fe��6e��+8OH��=FeO42��+4H2O�����Դ��ǣ�ʯī��Fe��6e��+8OH��=FeO42��+4H2O��


 ȫ��������ϵ�д�
ȫ��������ϵ�д� һ��һ����ʱ���ϵ�д�
һ��һ����ʱ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ��ƿ���ͼ��ʾ��̽��ԭ��ص�װ�ã������й�˵����ȷ���ǣ� ��
A.�缫���ϱ����ǽ�������
B.��a��Ϊͭ����b��ΪпƬ��cΪ������Һʱ�����ݻᷢ��
C.��a��Ϊ������b��ΪͭƬ��cΪŨ������Һʱ��ͭΪ����
D.��a��Ϊ������b��ΪþƬ��cΪϡ������Һʱ����Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��д������[KAl(SO4)212H2O]��ˮ�еĵ��뷽��ʽ______________________��������ˮ��ԭ������Ϊ����ˮ��Ӧ����_________��
��2����Һ�ĵ���������С��Ҫ��������Ũ�ȴ�С�����ģ�������Һ�嵼���Ե�ʵ��װ����������ͼ��ʾ��������ʵ�飬�����ܳ�������������Ϩ�������������______________
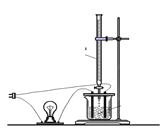
A.��BaCl2��Һ�е���ϡH2SO4
B.��Ba(OH)2��Һ�е���ϡH2SO4
C����NaOH��Һ�е�������
д����ѡ������ӷ�Ӧ����ʽ________________________________
��3��Mn2+��Bi3+��BiO3-��MnO4-��H+��H2O��ɵ�һ��������ԭ��Ӧ��ϵ�У�����BiO3-��Bi3+�ķ�Ӧ���̡��÷�Ӧ�У���������Ԫ����_______����������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭ��ض�Ӧ�ĵ缫��Ӧʽ��ȷ���ǣ� ��
A.����Ǧ���صĸ�����Pb��2e���TPb2+
B.п��Ŧ�۵�ص�������Ag2O+2e��+H2O�T2AgOH
C.����п�̵�صĸ�����Zn��2e��+2OH���TZn��OH��2
D.��������ȼ�ϵ�ص�������2H2O+4e���TO2+4H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ������Һ����Һ���ǣ� ��
A. �ȶ���Һ��B. ����Һ��C. �����D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����б仯��Ҫ��������������(����)
A.Cu��CuSO4B.CO2��COC.KClO3��Cl2D.H2O��H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA+B��C���������У���A+B��X����X��C����Ӧ�����������仯��ͼ��ʾ��E1��ʾ��ӦA+B��X�Ļ�ܣ������й�������ȷ���ǣ�������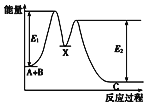
A.E2��ʾ��ӦX��C�Ļ��
B.X�Ƿ�ӦA+B��C�Ĵ���
C.��ӦA+B��C�ġ�H��0
D.��������ɸı䷴ӦA+B��C���ʱ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ����Ԫ�����ڱ���λ�ÿ�Ԥ����ԭ�ӽṹ�������ʵ���ɺͽṹ��ɾ������ʵ����ʣ�
��1����Ԫ�ط��ű�ʾ������![]()
![]()
![]()
![]()
,,,
��2������ԭ�ӽṹ��Ԫ��������֪ʶ������������ȷ����������ĸ��ţ���
A.���뾶��r��Al3+����r��Mg2+����r��Na+����r��F����r��O2��
B.�������ԣ�H3AlO3��H4SiO4��H3PO4��H2SO4��HClO4
C.�۵�ߵͣ�Li��Na��K��Rb��Cs
D.�������������׳̶ȣ�F2��Cl2��Br2��I2��N2
��3����X��Y��Z��W����Ԫ�أ���֪Y��X�γɵĻ�����YX�У�X�Ļ��ϼ�Ϊ��1��Y��Z�γɻ�����Y2Z��X��Y��Z���ӵĺ��������������18��W��+1�����Ӿ������ӣ�
�ٷֱ�д���������ʵĵ���ʽ��YX��W2Z ��
��д��X������Y������������Ӧ��ˮ���ﳣ���·�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ��ʵ�飬��x���ʾ���������ĵ��ӵ����ʵ�������y��ɱ�ʾ�� ��
��c��Ag+�� ��c��AgNO3�� ��a�������� ��b�������� ����Һ��pH��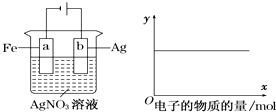
A.�٢�
B.�ۢ�
C.�٢ڢ�
D.�٢ڢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com