
����Ŀ������������Ԫ��X��Y��Z��R��T��ԭ�Ӱ뾶��ԭ��������ϵ��ͼ��ʾ��Rԭ�������������ǵ��Ӳ�����2����Y��Z���γ�Z2Y��Z2Y2�����ӻ����Z��T�γɵĻ�����Z2T���ƻ�ˮ�ĵ���ƽ�⣮�����ƶ���ȷ���ǣ�������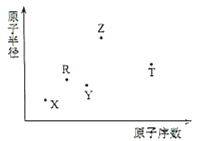
A.ԭ�Ӱ뾶�����Ӱ뾶�����㣺Y��Z
B.�⻯��ķе㲻һ���ǣ�Y��R
C.����������Ӧˮ��������ԣ�T��R
D.��X��R��Y��Z����Ԫ����ɵĻ�����ˮ��Һһ���Լ���
���𰸡�B
��������Rԭ�������������ǵ��Ӳ�����2��������ΪC��S������ͼʾԭ�Ӱ뾶��ԭ��������ϵ��֪RӦΪC��Y��Z���γ�Z2Y��Z2Y2�����ӻ����ӦΪNa2O��Na2O2 �� ��YΪO��ZΪNa��Z��T�γɵ�Z2T���������ƻ�ˮ�ĵ���ƽ�⣬TӦΪS��Na2Sˮ��ʼ��ԣ��ɴٽ�ˮ�ĵ��룻X��ԭ�Ӱ뾶��С��ԭ��������С��ӦΪHԪ�أ�
A��ԭ�Ӱ뾶O��Na�����Ӱ뾶O2����Na+ �� ��A����
B��RΪC����Ӧ���⻯��Ϊ�����纬̼ԭ�����϶࣬������Ϊ���壬�е�ϸߣ����⻯��ķе㲻һ���ǣ�Y��R����B��ȷ��
C���ǽ�����S��C��Ԫ�صķǽ�����Խǿ����Ӧ������������ˮ���������Խǿ����C����
D����H��C��O��Na����Ԫ����ɵĻ����ﲻ����ΪNaHCO3 �� ����Ϊ�л����Һ����Ȼ�����Һ��һ��Ϊ���ԣ�����Ϊ���ԣ���D����
��ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭ��ض�Ӧ�ĵ缫��Ӧʽ��ȷ���ǣ� ��
A.����Ǧ���صĸ�����Pb��2e���TPb2+
B.п��Ŧ�۵�ص�������Ag2O+2e��+H2O�T2AgOH
C.����п�̵�صĸ�����Zn��2e��+2OH���TZn��OH��2
D.��������ȼ�ϵ�ص�������2H2O+4e���TO2+4H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ����Ԫ�����ڱ���λ�ÿ�Ԥ����ԭ�ӽṹ�������ʵ���ɺͽṹ��ɾ������ʵ����ʣ�
��1����Ԫ�ط��ű�ʾ������![]()
![]()
![]()
![]()
,,,
��2������ԭ�ӽṹ��Ԫ��������֪ʶ������������ȷ����������ĸ��ţ���
A.���뾶��r��Al3+����r��Mg2+����r��Na+����r��F����r��O2��
B.�������ԣ�H3AlO3��H4SiO4��H3PO4��H2SO4��HClO4
C.�۵�ߵͣ�Li��Na��K��Rb��Cs
D.�������������׳̶ȣ�F2��Cl2��Br2��I2��N2
��3����X��Y��Z��W����Ԫ�أ���֪Y��X�γɵĻ�����YX�У�X�Ļ��ϼ�Ϊ��1��Y��Z�γɻ�����Y2Z��X��Y��Z���ӵĺ��������������18��W��+1�����Ӿ������ӣ�
�ٷֱ�д���������ʵĵ���ʽ��YX��W2Z ��
��д��X������Y������������Ӧ��ˮ���ﳣ���·�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ P��s���� Cl2��g��������Ӧ���� PCl3��g���� PCl5��g������Ӧ���̺�������ϵ��ͼ��ʾ��ͼ�еġ�H��ʾ���� 1 mol ��������ݣ���
������ͼ�ش��������⣺
��1��P��Cl2��Ӧ����PCl3���Ȼ�ѧ����ʽ��
��2��PCl5�ֽ�� PCl3��Cl2���Ȼ�ѧ����ʽ��
��3��P��Cl2��������Ӧ����1molPCl5�ġ�H3= P��Cl2һ����Ӧ����1molPCl5�ġ�H4 ��H3������ڡ�����С�ڡ����ڡ�����
��4��PCl5 ������ˮ��ַ�Ӧ���������������ᣬ��֪��Ӧǰ���Ԫ�ػ��ϼ۲��䣬�仯ѧ����ʽ�� 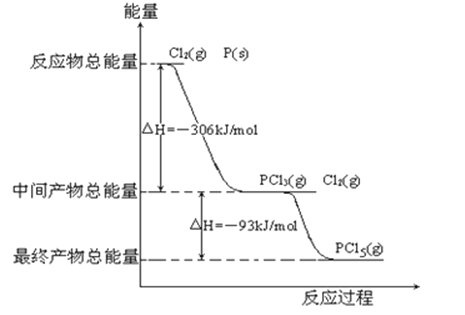
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ؿ������и�Ԫ����ռ���������Ӵ�С��˳���ǣ� ��
A.Al��Fe��Si��OB.O��Si��Al��Fe
C.Fe��Al��Si��OD.Si��O��Fe��Al
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��A��B�ķ���ʽ��ΪC6H10 �� ���ǵķ��ӽṹ����֧���������
��AΪ��״�����������Br2�����ӳɷ�Ӧ��A�������� ��
��BΪ��״ϩ��������Br2�ӳɺ�Ŀ��ܲ���ֻ�����֣�B�Ľṹ��ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ��ʵ�飬��x���ʾ���������ĵ��ӵ����ʵ�������y��ɱ�ʾ�� ��
��c��Ag+�� ��c��AgNO3�� ��a�������� ��b�������� ����Һ��pH��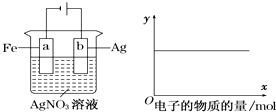
A.�٢�
B.�ۢ�
C.�٢ڢ�
D.�٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£�1molHe��1molCl2������ͬ�ģ� ��
A.ԭ����B.������C.����D.���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽�������ܲⶨ![]() ��
��![]() �������
�������![]() ������������
������������
A. ȡa�˻����������ϡ�����ַ�Ӧ���ݳ������ü�ʯ�����գ�����b��
B. ȡa�˻����������ϡ�����ַ�Ӧ�����ȡ����ɡ����գ���b�˹���
C. ȡa�˻�����ּ��ȣ�����b��
D. ȡa�˻����������![]() ��Һ��ַ�Ӧ�����ˡ�ϴ�ӡ���ɣ���b�˹���
��Һ��ַ�Ӧ�����ˡ�ϴ�ӡ���ɣ���b�˹���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com